Objectivos de aprendizagem
- Explicar porque é que os pontos de ebulição dos álcoois são superiores aos dos éteres e alcanos de massas molares semelhantes.
- Explicar porque é que os álcoois e éteres de quatro ou menos átomos de carbono são solúveis em água enquanto que os alcanos comparáveis não são solúveis.
Os álcoois podem ser considerados derivados da água (H2O; também escrito como HOH).

Como a ligação H-O-H na água, a ligação R-O-H é dobrada, e as moléculas de álcool são polares. Esta relação é particularmente aparente em moléculas pequenas e refletida nas propriedades físicas e químicas dos álcoois com baixa massa molar. A substituição de um átomo de hidrogênio de um alcano por um grupo OH permite que as moléculas se associem através da ligação de hidrogênio (Figura \PageIndex{1}}).
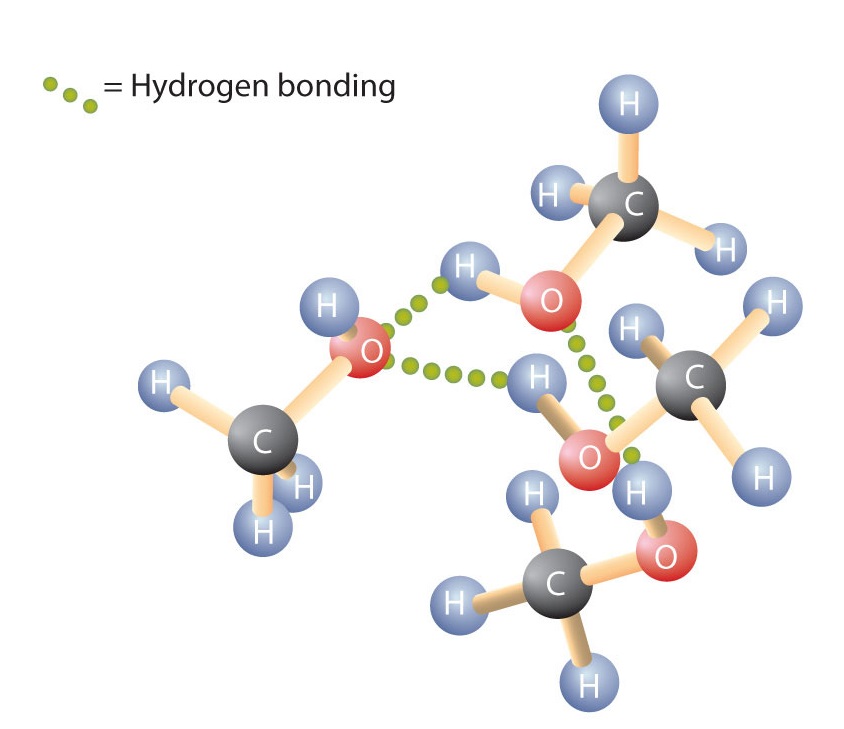
Recordar que as propriedades físicas são determinadas em grande parte pelo tipo de forças intermoleculares. A tabela {1}(PageIndex{1}) lista as massas molares e os pontos de ebulição de alguns compostos comuns. A tabela mostra que substâncias com massas molares similares podem ter pontos de ebulição bastante diferentes.
| Fórmula | Nome | Massa molar | Ponto de ebulição (°C) | |
|---|---|---|---|---|
| CH4 | metano | 16 | -164 | |
| HOH | água | 188> | 188> | 100 |
| C2H6 | etano | 30 | -89 | |
| CH3OH | metanol | 32 | 65 | |
| C3H8 | propano | 44 | -42 | |
| CH3CH2OH | etanol | 46 | 78 | |
| C4H10 | butano | 58 | -1 | |
| CH3CH2CH2OH | 1-propanol | 60 | 97 |
Os alcanos são não-polares e, portanto, só estão associados através de forças de dispersão relativamente fracas. Os alcanos com um a quatro átomos de carbono são gases à temperatura ambiente. Em contraste, mesmo o metanol (com um átomo de carbono) é um líquido à temperatura ambiente. A ligação ao hidrogênio aumenta muito os pontos de ebulição dos álcoois em comparação com os hidrocarbonetos de massa molar comparável. O ponto de ebulição é uma medida aproximada da quantidade de energia necessária para separar uma molécula líquida dos seus vizinhos mais próximos. Se as moléculas interagem através da ligação de hidrogênio, uma quantidade relativamente grande de energia deve ser fornecida para quebrar essas atrações intermoleculares. Somente então a molécula pode escapar do líquido para o estado gasoso.
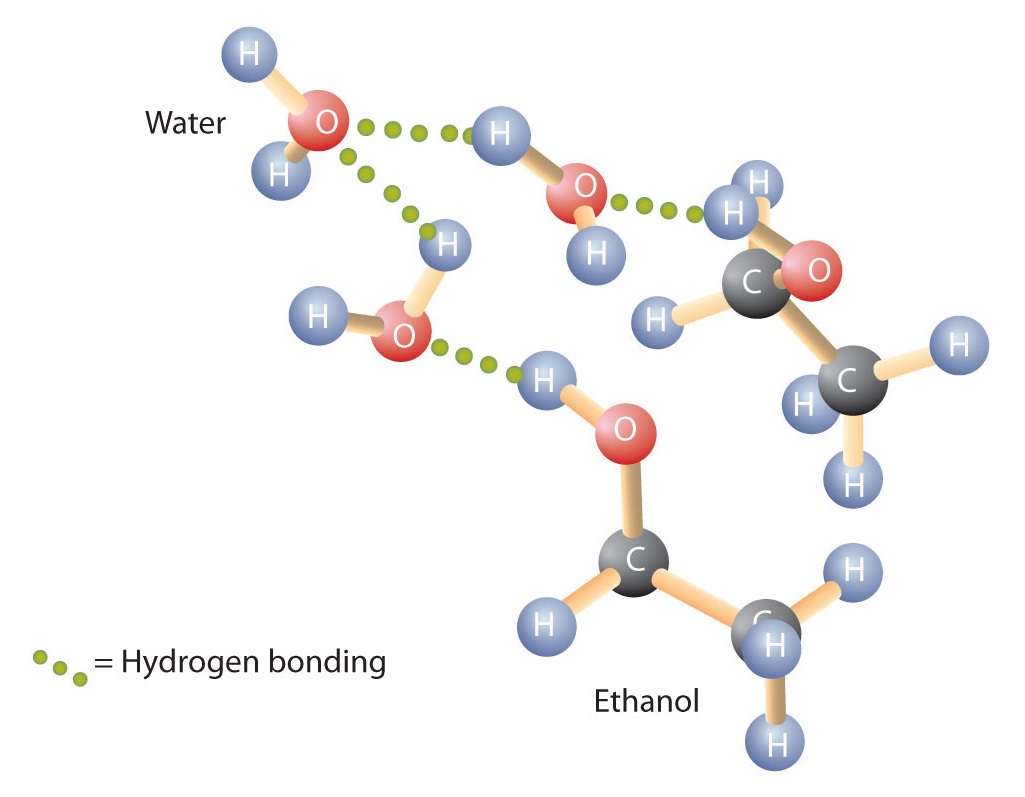
Os álcoois também podem se ligar ao hidrogênio com moléculas de água (Figura \PageIndex{2}). Assim, enquanto os hidrocarbonetos são insolúveis em água, os álcoois com um a três átomos de carbono são completamente solúveis. À medida que o comprimento da cadeia aumenta, entretanto, a solubilidade dos álcoois na água diminui; as moléculas tornam-se mais parecidas com os hidrocarbonetos e menos com a água. O álcool 1-decanol (CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2OH) é essencialmente insolúvel em água. Frequentemente encontramos que a fronteira da solubilidade numa família de compostos orgânicos ocorre em quatro ou cinco átomos de carbono.
Sumário
Os álcoois têm pontos de ebulição mais altos que os éteres e alcanos de massas molares similares, porque o grupo OH permite que as moléculas de álcool se liguem ao hidrogênio. Álcoois de quatro ou menos átomos de carbono são solúveis em água porque as moléculas de álcool se ligam ao hidrogênio com moléculas de água; moléculas de alcanos comparáveis não podem se ligar ao hidrogênio.
Exercícios de revisão de conceitos
-
Porquê o etanol é mais solúvel em água que o 1-hexanol?
-
Porquê o 1-butanol tem um ponto de ebulição mais baixo que o 1-hexanol?
Respostas
-
Etanol tem um grupo OH e apenas 2 átomos de carbono; o 1-hexanol tem um grupo OH para 6 átomos de carbono e por isso é mais parecido com um hidrocarboneto (não-polar) do que o etanol.
-
A massa molar do 1-hexanol é maior do que a do 1-butanol.
Exercícios
Responder aos seguintes exercícios sem consultar tabelas no texto.
-
Alterar estes álcoois por ordem de aumento do ponto de ebulição: etanol, metanol, e 1-propanol.
-
Que tem o maior ponto de ebulição – butano ou 1-propanol?
-
Arrange estes álcoois para aumentar a solubilidade em água: 1-butanol, metanol, e 1-octanol.
-
Arrange estes compostos em ordem de aumentar a solubilidade em água: 1-butanol, etanol, e pentano.
Respostas
-
metanol < etanol < 1-propanol
-
1-octanol < 1-butanol < metanol