Objectivos de Aprendizagem
- Conhecer a relação entre a força ácida ou de base e a magnitude dos \i(K_a), \i(K_b), \i(pK_a), e \i(pK_b).
- Para compreender o efeito de nivelamento.
A magnitude da constante de equilíbrio para uma reacção de ionização pode ser usada para determinar as forças relativas dos ácidos e bases. Por exemplo, a equação geral para a ionização de um ácido fraco em água, onde HA é o ácido pai e A- é sua base conjugada, é a seguinte:
>
A constante de equilíbrio para esta dissociação é a seguinte:
\}{} \Como notámos anteriormente, a concentração de água é essencialmente constante para todas as reacções em solução aquosa, pelo que na Equação (16.5.2) pode ser incorporada numa nova quantidade, a constante de ionização ácida (K_a), também chamada constante de dissociação ácida:
=dfrac{}{}{} \label{16.5.3}]
Assim, os valores numéricos de K e {(K_a}) diferem pela concentração de água (55.3 M). Mais uma vez, para simplificar, { H_3O^+} pode ser escrito como { H^++} na equação {16.5.3}}. Tenha em mente, porém, que livre (H^++) não existe em soluções aquosas e que um próton é transferido para H_2O em todas as reações de ionização ácida para formar íons de hidrônio, (H_3O^+). Quanto maior for o K_a, mais forte será a concentração de ácido e maior será a concentração de H++ em equilíbrio. Como todas as constantes de equilíbrio, as constantes de ionização ácido-base são na verdade medidas em termos das actividades de (H^++) ou (OH^-), tornando-as assim sem unidades. Os valores de K_a) para um número de ácidos comuns são dados na Tabela 1.
Bases fracas reagem com água para produzir o íon hidróxido, como mostrado na seguinte equação geral, onde B é a base mãe e BH+ é seu ácido conjugado:
>
A constante de equilíbrio para esta reação é a constante de ionização de base (Kb), também chamada de constante de dissociação de base:
\= \frac{}{}{} \A concentração de água é constante, pelo que não aparece na expressão constante de equilíbrio; em vez disso, está incluída na expressão {K_b}. Quanto maior for a {K_b}, mais forte será a base e maior será a concentração em equilíbrio. Os valores de { K_b} para um número de bases fracas comuns são dados na Tabela 2{2}.
Existe uma relação simples entre a magnitude de K_a para um ácido e K_b para a sua base conjugada. Considere, por exemplo, a ionização do ácido cianídrico (HCN) na água para produzir uma solução ácida, e a reação de \(CN^-\) com a água para produzir uma solução básica:
>
>
A expressão constante de equilíbrio para a ionização do HCN é a seguinte:
>>9774}{} \A expressão correspondente para a reacção de cianeto com água é a seguinte:
}{}{} \…]
Se adicionarmos Equações {16.5.6}} e {16.5.5.7), obtemos o seguinte:
| Reacção | Constantes de Equilíbrio |
|---|---|
| \(\ancelar{HCN_{(aq)}}} \H^+_{(aq)}+{CN^-_{(aq)}} \) | \(K_a=\ cancel{}/\\i} |
| \i(\i}{CN^-_{(aq)}}+H_2O_{(l)} \^-_{(aq)}+{HCN_{(aq)}) | (K_b====cancelar{}(K_b== |
| {(H_2O_{(l)} \H^+_{(aq)}+OH^-_{(aq)}) | \\(K=K_a \poss K_b=\) |
Neste caso, a soma das reacções descritas por K_a) e K_b) é a equação para a autoionização da água, e o produto das duas constantes de equilíbrio é K_w):
>
Assim, se soubermos ou { K_a} para um ácido ou { K_b} para a sua base conjugada, podemos calcular a outra constante de equilíbrio para qualquer par ácido-base conjugada.
Apenas como com { pH}, pOH}, e pKw, podemos usar logaritmos negativos para evitar notação exponencial na escrita de constantes de ionização de ácido e base, definindo a seguir:
>
>
e \(pK_b\) como
>
>
>
>Similiarmente, Equação \(\ref{16).5.10), que expressa a relação entre {K_a} e {K_b}, pode ser escrita de forma logarítmica como se segue:
>
A 25 °C, isto torna-se
>
Os valores de {\i1}(pK_a}) e {\i1}(pK_b}) são dados para vários ácidos e bases comuns nas Tabelas {\i}(PageIndex{\i}} e {\i1}(PageIndex{\i}2}), respectivamente, e um conjunto de dados mais extenso é fornecido nas Tabelas E1 e E2. Devido ao uso de logaritmos negativos, valores menores de {\i1}(pK_a}) correspondem a constantes de ionização ácida maiores e, portanto, ácidos mais fortes. Por exemplo, o ácido nitroso (HNO_2), com um 3,25, é cerca de um milhão de vezes mais ácido que o ácido cianídrico (HCN), com um 9,21. Por outro lado, valores menores de {\i1}(pK_b}) correspondem a constantes de ionização de bases maiores e, portanto, bases mais fortes.
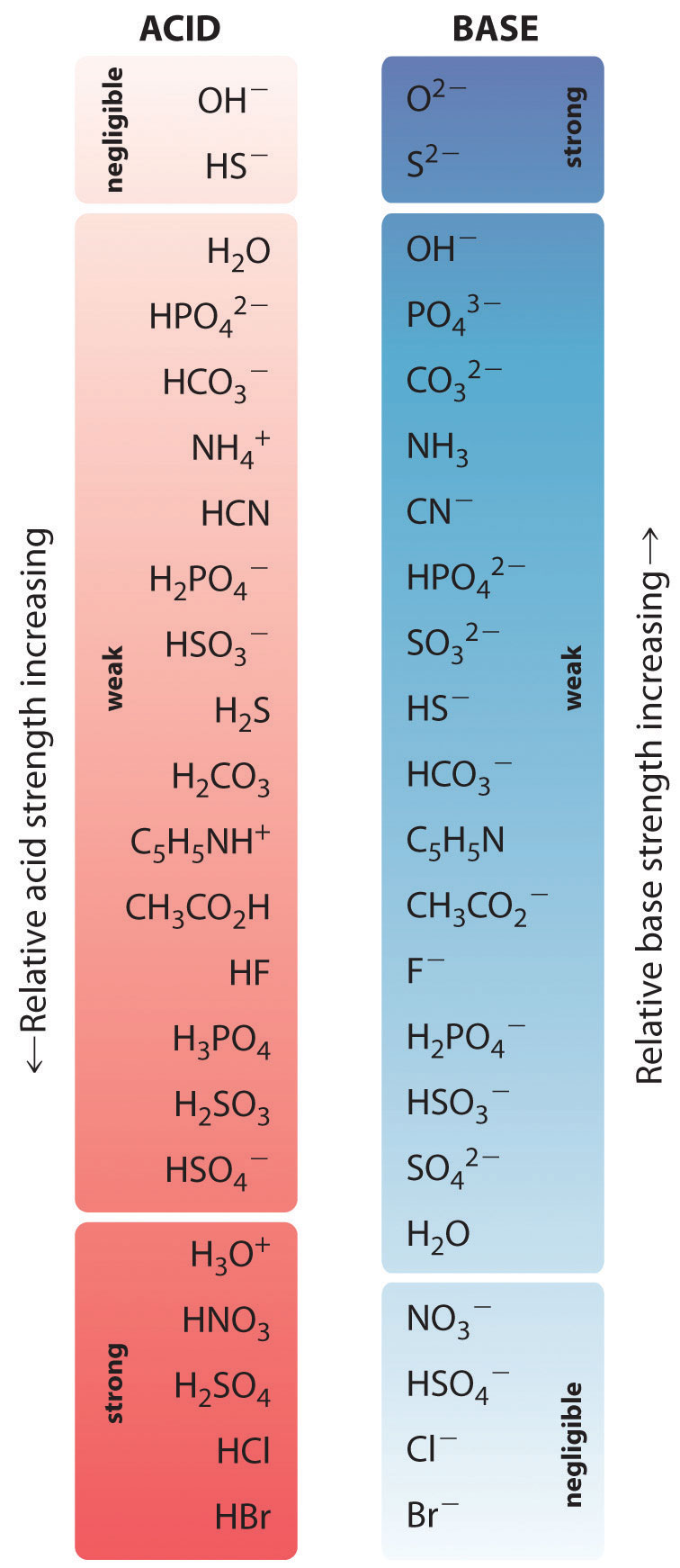
As forças relativas de alguns ácidos comuns e suas bases conjugadas são mostradas graficamente na Figura {1}(PageIndex{1}). Os pares de bases conjugadas ácido-base são listados em ordem (de cima para baixo) de força ácida crescente, o que corresponde a valores decrescentes de \\(pK_a). Esta ordem corresponde à resistência decrescente da base conjugada ou valores crescentes de \\(pK_b). Na parte inferior esquerda da figura (página 2) estão os ácidos fortes comuns; na parte superior direita estão as bases fortes mais comuns. Observe a relação inversa entre a força do ácido pai e a força da base conjugada. Assim a base conjugada de um ácido forte é uma base muito fraca, e a base conjugada de um ácido muito fraco é uma base forte.
A base conjugada de um ácido forte é uma base fraca e vice versa.
Podemos usar as forças relativas dos ácidos e bases para prever a direção de uma reação ácido-base seguindo uma única regra: um equilíbrio ácido-base sempre favorece o lado com o ácido e base mais fraca, como indicado por estas setas:
Numa reação ácido-base, o próton sempre reage com a base mais forte.
Por exemplo, o ácido clorídrico é um ácido forte que ioniza essencialmente em solução aquosa diluída para produzir ^(H_3O^+\) e ^(Cl^-\); apenas quantidades insignificantes de moléculas (HCl) permanecem não dissociadas. Assim, o equilíbrio de ionização está praticamente à direita, como representado por uma única seta:
>
Em contraste, o ácido acético é um ácido fraco, e a água é uma base fraca. Consequentemente, soluções aquosas de ácido acético contêm principalmente moléculas de ácido acético em equilíbrio com uma pequena concentração de \(H_3O^+\) e íons de acetato, e o equilíbrio de ionização fica longe à esquerda, como representado por estas setas:
Simplesmente, na reação de amônia com água, o íon hidróxido é uma base forte, e a amônia é uma base fraca, enquanto o íon amônia é um ácido mais forte que a água. Assim, este equilíbrio também se encontra à esquerda:
Todos os equilíbrios ácido-base favorecem o lado com o ácido e a base mais fraca. Assim, o próton está ligado à base mais forte.
Exemplo \(\PageIndex{1}}): Iões butirato e dimetilamónio
- Calcular {\i1}(K_b}) e {\i1}(pK_b}) do ião butirato (CH_3CH_2CH_2CO_2^-\i}). O {\i1}(pK_a} do ácido butírico a 25°C é 4,83. O ácido butírico é responsável pelo mau cheiro da manteiga rançosa.
- Calcular \(K_a) e \(pK_a) do ião dimetilamónio (\((CH_3)_2NH_2^+\)). A constante de ionização base (K_b) da dimetilamina (CH_3)_2NH_2)) está a 25°C.
Dado: \e {\i1}(pK_a} e {\i1}(K_b})
Passado para: correspondente {\i}(K_b} e {\i1}(pK_b}), {\i1}(K_a} e {\i1}(pK_a})
Estratégia:
As constantes \i(K_a) e \i(K_b) estão relacionadas como mostra a equação {\i}({\i1}ref{\i(16).5.10}\). As constantes {\i1}(pK_a} e {\i_b} para um ácido e sua base conjugada estão relacionadas, como mostrado nas equações {\i}(16.5.15}) e {\i}(16.5.16). Use as relações pK = -log K e K = 10-pK (Equações {16.5.11}) e {16.5.13}) para converter entre {K_a} e {pK_a} ou {K_b} e {pK_b}.
Solução:
Solução:
Recebemos o {\i1}(pK_a}) para o ácido butírico e pedimos para calcular o {\i}(K_b}) e o {\i1}(pK_b}) para a sua base conjugada, o ião butirato. Como o valor citado é para uma temperatura de 25°C, podemos usar a Equação Ref (16.5.16): + (pK_a) + (pK_b) = pKw = 14.00. Substituindo o \\\i(pK_a) e resolvendo para o\i(pK_b),
>
>
>
porque \i(pK_b = -log K_b), \i(K_b) é \i(10^{-9.17} = 6.8 \i(10^).
Neste caso, nos dão {\i1}(K_b}) uma base (dimetilamina) e nos pedem para calcular {\i}(K_a} e {\i1}(pK_a}) para seu ácido conjugado, o íon dimetilamônio. Como a quantidade inicial dada é K_b em vez de pK_b, podemos usar a equaçãoref{16.5.10}): \(K_aK_b = K_w). Substituindo os valores de \(K_b) e \(K_w) a 25°C e resolvendo para \(K_a),
>
>
>
Porque \(pK_a) = -log \(K_a), temos \(pK_a = -\log(1.9 ^{-11}) = 10.72\). Também podíamos ter convertido a resposta:
>
>
>
>
Se nos for dada qualquer uma destas quatro quantidades para um ácido ou uma base (K_a), { pK_a}, { K_b}, ou { pK_b}), podemos calcular as outras três.
Exercicio {1}(PageIndex{1}}): Ácido láctico
Ácido láctico (\ CH_3CH(OH)CO_2H\)) é responsável pelo sabor e cheiro pungente do leite azedo; também se pensa que produz dor nos músculos fatigados. Seu {\i1}(pK_a}) é de 3,86 a 25°C. Calcule \(K_a) para o ácido láctico e \(pK_b) e \(K_b) para o íon lactato.
Resposta
- \(K_a = 1.4 ^{-4}}) para o ácido láctico;
- \(pK_b\) = 10.14 e
- \(K_b = 7,2 ^{-11}\) para o íon lactato
Soluções de Ácidos e Bases Fortes: O Efeito de Nivelamento
Vai notar na Tabela {1}(PáginaIndex{1}) que ácidos como o { H_2SO_4} e o { HNO_3} estão acima do íon hidrônio, significando que eles têm valores inferiores a zero e são ácidos mais fortes que o íon H_3O^+). Lembre-se do Capítulo 4 que o próton ácido em praticamente todos os oxoácidos está ligado a um dos átomos de oxigénio do oxoanião. Assim, o ácido nítrico deve ser escrito apropriadamente como HONO_2. Infelizmente, no entanto, as fórmulas dos oxoácidos são quase sempre escritas com hidrogênio à esquerda e oxigênio à direita, dando ao invés disso {(HNO_3}). Na verdade, todos os seis ácidos fortes comuns que encontramos pela primeira vez no Capítulo 4 têm valores inferiores a zero, o que significa que eles têm uma maior tendência a perder um próton do que o íon H_3O^+). Ao contrário, as bases conjugadas destes ácidos fortes são bases mais fracas do que a água. Consequentemente, os equilíbrios de transferência de prótons para estes ácidos fortes estão longe à direita, e adicionar qualquer um dos ácidos fortes comuns à água resulta em uma reação essencialmente estequiométrica do ácido com a água para formar uma solução do íon ^(H_3O^+) e a base conjugada do ácido.
Embora K_a para HI seja cerca de 108 maior que K_a para HNO_3, a reacção de HNO_3 com água dá uma solução essencialmente estequiométrica de H_3O^+ e I- ou NO_3^-). Na verdade, uma solução aquosa 0,1 M de qualquer ácido forte contém 0,1 M (H_3O^+), independentemente da identidade do ácido forte. Este fenômeno é chamado efeito de nivelamento: qualquer espécie que seja um ácido mais forte que o ácido conjugado da água (H_3O^+) é nivelado à força do H_3O^+) em solução aquosa porque o H_3O^+) é o ácido mais forte que pode existir em equilíbrio com a água. Consequentemente, é impossível distinguir entre as forças de ácidos como HI e HNO3 em solução aquosa, e uma abordagem alternativa deve ser usada para determinar suas forças ácidas relativas.
Um método é usar um solvente como o ácido acético anidro. Como o ácido acético é um ácido mais forte que a água, ele também deve ser uma base mais fraca, com menor tendência a aceitar um próton do que \(H_2O\). As medições da condutividade de soluções 0,1 M tanto de HI quanto de HNO_3 no ácido acético mostram que o HI está completamente dissociado, mas o HNO_3 só está parcialmente dissociado e se comporta como um ácido fraco neste solvente. Este resultado diz-nos claramente que o HI é um ácido mais forte do que o HNO_3. A ordem relativa das forças ácidas e os valores aproximados para os ácidos fortes no topo da tabela (K_a) e pK_a) foram determinados usando medidas como esta e diferentes solventes não aquosos.
Em soluções aquosas, \\(H_3O^+\) é o ácido mais forte e \(OH^-\) é a base mais forte que pode existir em equilíbrio com \(H_2O\).
O efeito de nivelamento também se aplica a soluções de bases fortes: Em solução aquosa, qualquer base mais forte que OH- é nivelada à força de OH- porque OH- é a base mais forte que pode existir em equilíbrio com a água. Sais como K_2O, NaOCH_3 (metóxido de sódio) e NaNH_2 (sodamida, ou amida de sódio), cujos ânions são as bases conjugadas de espécies que ficariam abaixo da água na Tabela 2, são todas bases fortes que reagem essencialmente completamente (e muitas vezes violentamente) com a água, aceitando um próton para dar uma solução de OH^- e o catião correspondente:
Outros exemplos que pode encontrar são hidreto de potássio (KH) e compostos organometálicos como o metil lítio (CH_3Li)).
Ácidos e Bases Polipróticos
Como você aprendeu, ácidos polipróticos tais como \(H_2SO_4\), \(H_3PO_4\), e \(H_2CO_3\) contêm mais de um próton ionizável, e os prótons são perdidos de forma gradual. A espécie totalmente protonada é sempre a mais forte porque é mais fácil remover um próton de uma molécula neutra do que de um íon carregado negativamente. Assim a força ácida diminui com a perda dos prótons subseqüentes, e, correspondentemente, o {\i1}(pK_a}) aumenta. Considere \(H_2SO_4\), por exemplo:
>
O equilíbrio na primeira reacção situa-se longe à direita, consistente com o facto de \(H_2SO_4\) ser um ácido forte. Em contraste, na segunda reacção, quantidades apreciáveis tanto de { HSO_4^-} como de { SO_4^{2-}} estão presentes no equilíbrio.
Para um ácido poliprótico, a força ácida diminui e o {(pK_a}) aumenta com a perda sequencial de cada próton.
O ião sulfato de hidrogénio (HSO_4^-)) é tanto a base conjugada de H_2SO_4^) como o ácido conjugado de SO_4^{2-}. Assim como a água, HSO4- pode, portanto, agir como um ácido ou uma base, dependendo se o outro reagente é um ácido mais forte ou uma base mais forte. Ao contrário, o íon sulfato (SO_4^{2-}) é uma base poliprótica capaz de aceitar dois prótons de forma gradual:
>
>
>
Como qualquer outro par ácido de base conjugada, as forças dos ácidos e bases conjugadas estão relacionadas por {(pK_a} + {(pK_b}) = pKw. Considere, por exemplo, o par Ácido-base conjugado {\i1}(HSO_4^-/ SO_4^{\i}}). Da Tabela 1, vemos que o Par Ácido-base do HSO 4 é 1,99. Daí que o {\i1}(pK_b}) do {\i1}(SO_4^_2-}) seja 14.00 – 1.99 = 12.01. Assim, o sulfato é uma base bastante fraca, enquanto que o sulfato é uma base forte, portanto o equilíbrio mostrado na equação fica à esquerda. O íon HSO_4^-) também é uma base muito fraca (pK_a) de H_2SO_4 = 2.0, pK_b) de HSO_4^- = 14 – (-2.0) = 16), o que é consistente com o que esperamos para a base conjugada de um ácido forte.
Exemplo \(\PageIndex{2})
Prever se o equilíbrio para cada reacção está à esquerda ou à direita como escrito.
- \(NH^++_{4(aq)}+PO^{3-}_{4(aq)} \rightleftharpoons NH_{3(aq)}+HPO^{2−}_{4(aq)}\)
- \(CH_3CH_2CO_2H_{(aq)}+CN^−_{(aq)} \rightleftharpoons CH_3CH_2CO^-__{2(aq)}+HCN_{(aq)})
Dado: equação química equilibrada
Passado para: posição de equilíbrio
Estratégia:
Identificar os pares de base ácido-base conjugada em cada reacção. Depois consulte as Tabelas {1}(PageIndex{2}) e {2}(PageIndex) e a Figura {2}(PageIndex) para determinar qual é o ácido e a base mais fortes. Equilíbrio sempre favorece a formação do par ácido-base mais fraco.
Solução:
Os pares ácido-base conjugados são \(NH_4^+/NH_3\) e \(HPO_4^{2-}/PO_4^{3-}). De acordo com as Tabelas 1 e 2, NH_4^+) é um ácido mais forte (pK_a = 9.25\\)) do que (HPO_4^{2-}) (pKa = 12.32), e { PO_4^{3-}) é uma base mais forte (pK_b = 1.68\)) do que (NH_3\) (pK_b = 4.75\)). O equilíbrio, portanto, ficará à direita, favorecendo a formação do par ácido-base mais fraco:
>
Os pares ácido-base conjugados são \(CH_3CH_2CO_2H/CH_3CH_2CO_2^-\) e \(HCN/CN^-\). De acordo com a Tabela 1, o HCN é um ácido fraco (pKa = 9,21) e o CN é uma base moderadamente fraca (pKb = 4,79). O ácido propiónico (CH_3CH_2CO_2H) não está listado na Tabela {1}(PageIndex{1}}), no entanto. Numa situação como esta, a melhor abordagem é procurar um composto similar cujas propriedades ácido-base estão listadas. Por exemplo, ácido propiônico e ácido acético são idênticos, exceto para os grupos ligados ao átomo de carbono do ácido carboxílico (cf. CH_2CH_3) versus cf. CH_3), então podemos esperar que os dois compostos tenham propriedades ácido-base semelhantes. Em particular, esperaríamos que o ácido propiónico fosse semelhante em magnitude ao ácido acético. (Na verdade, o ácido propiônico é 4,87, comparado com 4,76 para o ácido acético, o que torna o ácido propiônico um ácido ligeiramente mais fraco do que o ácido acético). Assim, o ácido propiônico deve ser um ácido significativamente mais forte do que o ácido acético (HCN). Como o ácido mais forte forma a base conjugada mais fraca, nós prevemos que o cianeto será uma base mais forte do que o propionato. O equilíbrio, portanto, ficará à direita, favorecendo a formação do par ácido-base mais fraco:
>
Exercício \(\PageIndex{1})
Prever se o equilíbrio para cada reação fica à esquerda ou à direita como escrito.
- \\(H_2O_{(l)}+HS^-_{(aq)} \rightleftharpoons OH^−_{(aq)}+H_2S_{(aq)}\)
- \(HCO^−_{2(aq)}+HSO^−_{4(aq)} \HCO_2H_{(aq)}+SO^{2-}_{4(aq)})
Resposta a
esquerda
Resposta b
esquerda
Resumo
Reacções ácido-base contêm sempre dois pares conjugados ácido-base. Cada ácido e cada base tem uma constante de ionização associada que corresponde ao seu ácido ou força de base. Duas espécies que diferem apenas por um próton constituem um par ácido-base conjugado. A magnitude da constante de equilíbrio para uma reação de ionização pode ser usada para determinar as forças relativas de ácidos e bases. Para uma solução aquosa de um ácido fraco, a constante de dissociação é chamada de constante de ionização ácida (K_a)). Da mesma forma, a constante de equilíbrio para a reacção de uma base fraca com água é a constante de ionização de base (K_b)). Para qualquer par conjugado base ácido-base, { K_aK_b = K_w}). Valores menores de {\i1}(pK_a}) correspondem a constantes de ionização ácida maiores e, portanto, ácidos mais fortes. Inversamente, valores menores de {pK_b} correspondem a constantes de ionização de base maiores e, portanto, bases mais fortes. A 25°C, { pK_a + pK_b = 14,00}. As reações ácido-base sempre procedem na direção que produz o par ácido-base mais fraco. Não pode existir ácido mais forte que o H_3O^+) e nenhuma base mais forte que o OH^-) em solução aquosa, levando ao fenômeno conhecido como efeito de nivelamento. Ácidos polipróticos (e bases) perdem (e ganham) prótons de forma gradual, sendo as espécies totalmente protonadas as mais fortes e as espécies totalmente desprotonadas as mais fortes.
Equações Chave
- Constante de ionização ácida: \=dfrac{}{}{} \]
- Ionização de base constante: \= Frac{}{}
- Relação entre K_a) e K_b) de um par conjugado ácido-base:
- Definição de {\i1}(pK_a}): \ 1221>
- Definição de..:
- Relação entre o par ácido conjugado (pK_a) e o par ácido conjugado (pK_b):
Contribuidores e Atribuições
-
Stephen Lower, Professor Emérito (Simon Fraser U.) Chem1 Virtual Textbook