Entropia
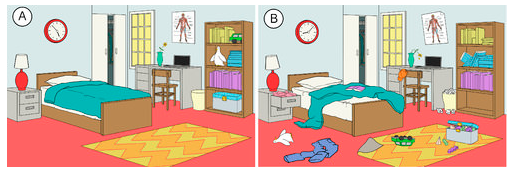
Há uma tendência na natureza para que os sistemas prossigam para um estado de maior desordem ou aleatoriedade. A entropia é uma medida do grau de aleatoriedade ou desordem de um sistema. A entropia é um conceito fácil de entender quando se pensa em situações cotidianas. A entropia de uma sala que foi recentemente limpa e organizada é baixa. Com o passar do tempo, ela provavelmente se tornará mais desordenada e assim sua entropia aumentará (veja a figura abaixo). A tendência natural de um sistema é para que sua entropia aumente.
Reacções químicas também tendem a proceder de forma a aumentar a entropia total do sistema. Como você pode dizer se uma certa reação mostra um aumento ou uma diminuição da entropia? O estado molecular dos reagentes e dos produtos fornece certas pistas. Os casos gerais abaixo ilustram a entropia a nível molecular.
- Para uma determinada substância, a entropia do estado líquido é maior do que a entropia do estado sólido. Da mesma forma, a entropia do gás é maior do que a entropia do líquido. Portanto, a entropia aumenta nos processos em que os reagentes sólidos ou líquidos formam produtos gasosos. A entropia também aumenta quando os reagentes sólidos formam produtos líquidos.
- Entropia aumenta quando uma substância é decomposta em várias partes. O processo de dissolução aumenta a entropia porque as partículas do soluto tornam-se separadas umas das outras quando uma solução é formada.
- Entropia aumenta quando a temperatura aumenta. Um aumento na temperatura significa que as partículas da substância têm maior energia cinética. As partículas em movimento mais rápido têm mais desordem do que as partículas que se movem mais lentamente a uma temperatura mais baixa.
- Entropia geralmente aumenta nas reacções em que o número total de moléculas do produto é maior do que o número total de moléculas reagentes. Uma exceção a esta regra é quando um gás está sendo produzido a partir de reagentes não gasosos.
Os exemplos abaixo servirão para ilustrar como a mudança de entropia em uma reação pode ser prevista.
\(\ce{Cl_2} \esquerda (g) direita (righttarrow)ce{Cl_2} \esquerda( l {CaCO_3})
A entropia está diminuindo porque um gás está se tornando um líquido.
({CaCO_3} \esquerda( s) direita) direita direita direita (caO) \esquerda( s) + direita) +ce{CO_2} \esquerda( g {\i1}direita)
A entropia está a aumentar porque um gás está a ser produzido e o número de moléculas está a aumentar.
({N_2} \esquerda ( g direita) + 3ce{H_2} \esquerda ( g direita) direita direita 2ce{NH_3} \esquerda( g \i1}direita)
A entropia está a diminuir porque quatro moléculas totais reagentes estão a formar duas moléculas totais de produto. Todas são gases.
({AgNO_3}({AgNO_3}) \esquerda( aq direita) +ce{NaCl} \esquerda ( aq direita) direita direita direita direita (NaNO_3) \esquerda ( aq direita) + cee{AgCl} \esquerda( s {s {direita)})
A entropia está a diminuir porque um sólido é formado por reagentes aquosos.
({H_2} \esquerda ( g direita) + c^_2} \esquerda ( g direita) direita direita 2… \esquerda( g \ direita)
A mudança de entropia é desconhecida (mas provavelmente não zero), porque há igual número de moléculas em ambos os lados da equação e todas são gases.