O Modelo Atômico
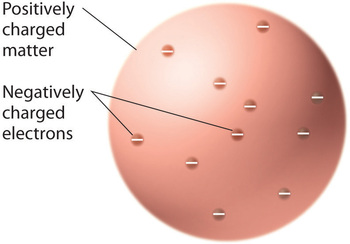
Os cientistas concluíram que toda matéria contém elétrons com carga negativa, ficou claro que os átomos, que são eletricamente neutros, também devem conter cargas positivas para equilibrar as negativas. Thomson propôs que os elétrons estavam embutidos em uma esfera uniforme que continha tanto a carga positiva quanto a maior parte da massa do átomo, muito parecido com passas em pudim de ameixa ou lascas de chocolate em um biscoito (Figura \PageIndex (9))
2.4.6
Figure \PageIndex (9)): Thomson’s Plum Pudding ou Chocolate Chip Cookie Model of the Atom. Neste modelo, os elétrons estão embutidos em uma esfera uniforme de carga positiva. Imagem usada com Permission (CC BY-SA-NC).
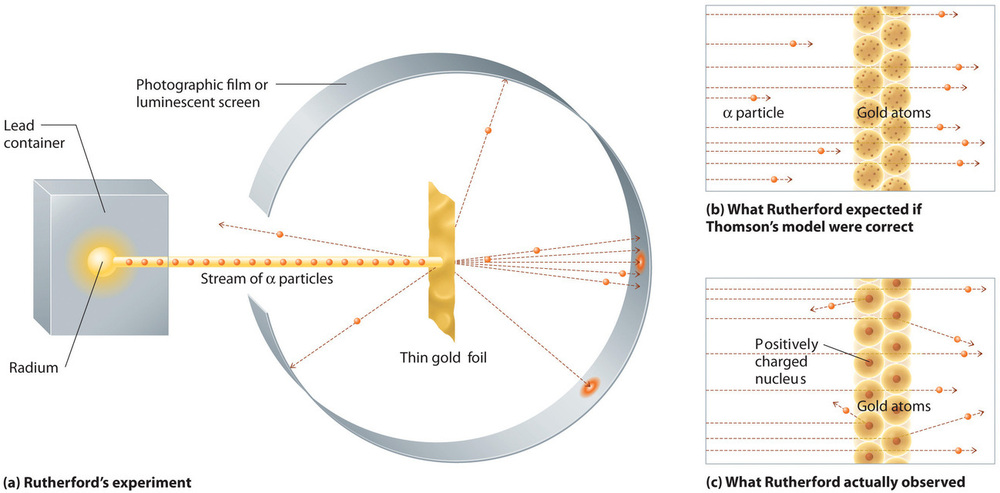
Em uma única experiência famosa, porém, Rutherford mostrou sem ambiguidade que o modelo do átomo de Thomson estava incorreto. Rutherford apontou um fluxo de partículas de α para um alvo de folha de ouro muito fino (Figura \PageIndex{10a}}) e examinou como as partículas de α estavam espalhadas pela folha de alumínio. O ouro foi escolhido porque podia ser facilmente martelado em folhas extremamente finas, minimizando o número de átomos no alvo. Se o modelo do átomo de Thomson estivesse correto, as partículas de α, carregadas positivamente, deveriam colidir com a massa uniformemente distribuída do alvo de ouro, como bolas de canhão, através do lado de uma casa de madeira. Elas podem estar se movendo um pouco mais lentamente quando emergiram, mas devem passar essencialmente diretamente através do alvo (Figura 10b). Para o espanto de Rutherford, uma pequena fração das partículas de α foram desviadas em grandes ângulos, e algumas foram refletidas diretamente de volta à fonte (Figura 10c). De acordo com Rutherford, “Foi quase tão incrível como se você disparasse uma casca de 15 polegadas em um pedaço de papel tissue e ele voltasse e atingisse você”
2.4.7
Figure {10}(PageIndex{10c}): Um resumo das experiências de Rutherford. (a) Uma representação do aparelho que Rutherford usou para detectar deflexões em um fluxo de α partículas destinadas a um alvo de folha fina de ouro. As partículas eram produzidas por uma amostra de rádio. (b) Se o modelo do átomo de Thomson estivesse correto, as partículas de α deveriam ter passado diretamente através da folha de ouro. (c) Entretanto, um pequeno número de partículas de α foram desviadas em várias direções, inclusive de volta à fonte. Isto só poderia ser verdade se a carga positiva fosse muito mais maciça do que a partícula α. Ele sugeriu que a massa do átomo de ouro está concentrada em uma região muito pequena do espaço, que ele chamou de núcleo. Imagem usada com Permission (CC BY-SA-NC).
Rutherford não era consistente com um modelo em que a massa e a carga positiva são distribuídas uniformemente pelo volume de um átomo. Ao invés disso, eles sugeriram fortemente que tanto a massa quanto a carga positiva estão concentradas em uma pequena fração do volume de um átomo, que Rutherford chamou de núcleo. Fazia sentido que uma pequena fração das partículas do α colidisse com os núcleos densos, carregados positivamente, de uma forma brilhante, resultando em grandes deflexões, ou quase de frente, fazendo com que fossem refletidas diretamente de volta à fonte.
Embora Rutherford não conseguisse explicar porque as repulsões entre as cargas positivas nos núcleos que continham mais de uma carga positiva não causavam a desintegração do núcleo, ele raciocinou que as repulsões entre os elétrons com carga negativa causariam a distribuição uniforme dos elétrons ao longo do volume do átomo.Hoje é sabido que forças nucleares fortes, que são muito mais fortes que as interações eletrostáticas, mantêm os prótons e os nêutrons juntos no núcleo. Por este e outros insights, Rutherford foi agraciado com o Prêmio Nobel de Química em 1908. Infelizmente, Rutherford teria preferido receber o Prêmio Nobel de Física porque ele considerava a física superior à química. Na sua opinião, “Toda a ciência ou é física ou recolha de selos”
 2.4.8
2.4.8
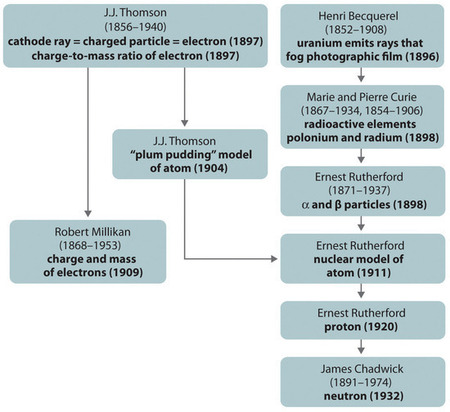
Figure {11}(PageIndex{11}): Um resumo do desenvolvimento histórico dos modelos dos componentes e estrutura do átomo. As datas entre parênteses são os anos em que as principais experiências foram realizadas. Imagem usada com Permissão (CC BY-SA-NC).
O desenvolvimento histórico dos diferentes modelos da estrutura do átomo está resumido em (Figura \PageIndex{11}}) Rutherford estabeleceu que o núcleo do átomo de hidrogênio era uma partícula com carga positiva, para a qual ele cunhou o nome protão em 1920. Ele também sugeriu que os núcleos de elementos que não o hidrogênio devem conter partículas eletricamente neutras com aproximadamente a mesma massa que o próton. O nêutron, porém, não foi descoberto até 1932, quando James Chadwick (1891-1974, estudante de Rutherford; Prêmio Nobel de Física, 1935) o descobriu. Como resultado do trabalho de Rutherford, ficou claro que uma partícula de α contém dois prótons e nêutrons, e é portanto o núcleo de um átomo de hélio.
2.4.9
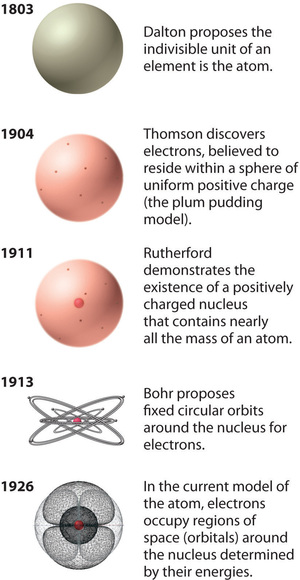
Figure {12}(PageIndex{12}): A Evolução da Teoria Atómica, como Ilustrado pelos Modelos do Átomo de Oxigénio. O modelo de Bohr e o modelo atual são descritos no Capítulo 6, “A Estrutura dos Átomos”. Imagem usada com Permission (CC BY-SA-NC).
O modelo do átomo de Rutherford é essencialmente o mesmo que o modelo moderno, exceto que agora se sabe que os elétrons não estão uniformemente distribuídos ao longo do volume de um átomo. Ao invés disso, eles são distribuídos de acordo com um conjunto de princípios descritos pela Mecânica Quântica. A figura {12} mostra como o modelo do átomo evoluiu ao longo do tempo da unidade indivisível de Dalton para a visão moderna ensinada hoje.