- Introdução
- Patofisiologia
- Fator de risco
- Apresentação clínica
- Lei de Courvoisier
- Diagnóstico diferencial
- Investigações
- Testes laboratoriais
- Imaging
- Gestão
- Cirurgia
- Procedimento de Whipple
- Chemoterapia
- Cuidados Paliativos
- Prognóstico
- Key Points
- Tumores endócrinos do pâncreas
- Características clínicas
- Investigação
- Gerenciamento
Introdução
Câncer pancreático se refere tipicamente ao carcinoma ductal do pâncreas, que compreende até 90% das malignidades pancreáticas primárias. O número restante pode ser dividido em tumores exócrinos (como o carcinoma cístico pancreático) e tumores endócrinos (derivados de células de ilhotas do pâncreas).
Câncer pancreático tem uma alta taxa de mortalidade, sendo a 4ª causa mais comum de morte por câncer no Reino Unido. É raro com menos de 40 anos de idade, com 80% dos casos ocorrendo entre 60-80 anos. Raramente é diagnosticado suficientemente cedo para tratamento curativo.
Neste artigo, vamos analisar os fatores de risco, investigações e manejo de um paciente com câncer pancreático.
Patofisiologia
O tipo mais comum de câncer pancreático é o carcinoma ductal (90% das neoplasias malignas do pâncreas primárias). Outras formas mais raras incluem tumores císticos, tumores de células ampulares e tumores de células de ilhotas, que muitas vezes têm um prognóstico muito melhor.
Asso que o câncer se espalha, a invasão direta das estruturas locais envolve tipicamente o baço, o cólon transversal e as glândulas supra-renais. A metástase linfática envolve tipicamente os linfonodos regionais, o fígado, os pulmões e o peritônio. A metástase é comum no momento do diagnóstico.
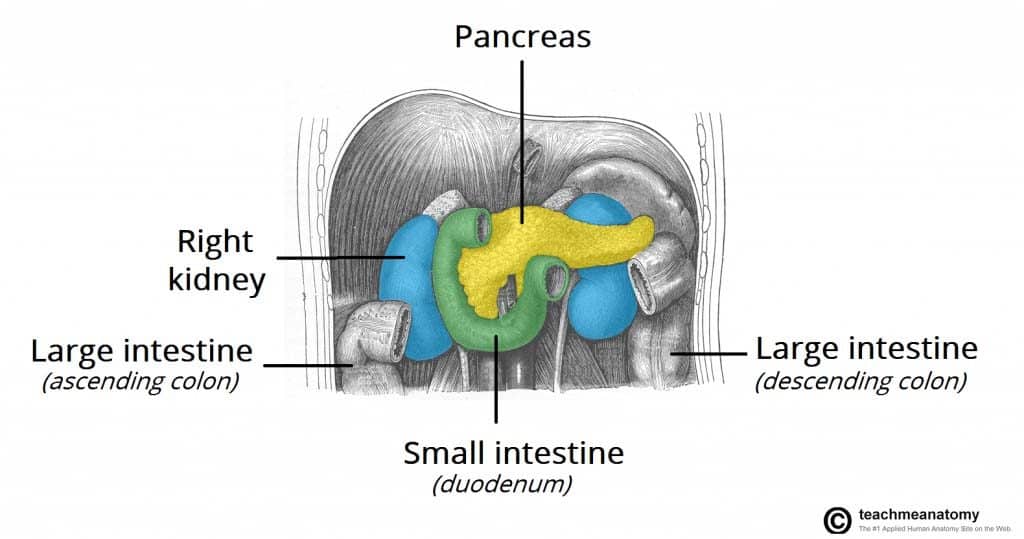 Figura 1 – O câncer do pâncreas pode se espalhar diretamente para estruturas circundantes, como o baço, cólon transversal e glândula adrenal.
Figura 1 – O câncer do pâncreas pode se espalhar diretamente para estruturas circundantes, como o baço, cólon transversal e glândula adrenal.Fator de risco
Existem poucos fatores de risco claros para o desenvolvimento de carcinoma do pâncreas. Os que foram identificados incluem o tabagismo e a pancreatite crônica. Também pode haver um elemento hereditário, já que 7% dos pacientes têm uma história familiar da doença.
O diabetes mellitus de início tardio é um fator de risco adicional. Aqueles diagnosticados com diabetes >50 anos têm um risco 8x maior de desenvolver carcinoma pancreático nos três anos seguintes do que a população em geral.
Apresentação clínica
Aproximadamente 80% dos casos de carcinoma pancreático são irreconhecíveis no momento do diagnóstico, comprovando a natureza tardia e muitas vezes vaga e inespecífica da sua apresentação.
As características clínicas específicas* podem depender do local do tumor:
- Icterícia obstrutiva – devido à compressão do ducto biliar comum (presente em 90% dos casos no momento do diagnóstico), normalmente indolor
- Perda de peso – devido aos efeitos metabólicos do cancro, ou secundária à disfunção exócrina
- Dor abdominal (inespecífica) – devido à invasão do plexo celíaco ou secundária à pancreatite
Sem apresentações comuns incluem pancreatite aguda ou tromboflebite migrans (uma tromboflebite superficial migratória recorrente, causada por um estado paraneoplásico hipercoagulável).
*Tumores da cauda do pâncreas têm um curso insidioso e frequentemente não sintomático até um estágio tardio
No exame, os pacientes podem parecer caquéticos, desnutridos e com icterícia. À palpação, uma massa abdominal na região epigástrica pode ser sentida, assim como uma vesícula biliar aumentada (conforme a Lei de Courvoisier)
Lei de Courvoisier
Lei de Courvoisier afirma que na presença de icterícia e vesícula biliar aumentada/palpável, A malignidade da árvore biliar ou do pâncreas deve ser fortemente suspeita, pois é pouco provável que a causa seja cálculos biliares.
Este sinal pode estar presente se o tumor obstrutivo for distal ao ducto cístico. Na realidade, uma vesícula biliar aumentada está presente em menos de 25% dos pacientes com cancro do pâncreas.
Diagnóstico diferencial
Câncer pancreático apresenta frequentemente características vagas, não específicas. Os diagnósticos diferenciais são vastos e incluem:
- Causas de icterícia obstrutiva – doença dos cálculos biliares, colangiocarcinoma, estreitamento benigno da vesícula biliar
- Causas de dor abdominal epigástrica – cálculos biliares, doença da úlcera péptica, carcinoma gástrico, síndrome coronariana aguda
Investigações
Testes laboratoriais
Uma suspeita de câncer pancreático deve justificar testes iniciais de sangue, incluindo hemograma (anemia ou trombocitopenia) e LFT (bilirrubina elevada, fosfatase alcalina e gama-GT, mostrando um quadro de icterícia obstrutiva).
CA19-9 é um marcador tumoral com alta sensibilidade e especificidade para câncer pancreático, porém seu papel é avaliar a resposta ao tratamento e não ao diagnóstico inicial.
Imaging
A imagem inicial para câncer pancreático é comumente um ultrassom abdominal, que pode demonstrar uma massa pancreática ou uma árvore biliar dilatada (assim como potenciais metástases hepáticas e ascite se doença em estágio muito tardio).
A TC (usando um protocolo pancreático, Fig. 2) é a investigação mais importante em termos de diagnóstico, mas também a mais prognosticada, já que pode encenar a progressão da doença. Uma tomografia computadorizada tórax-abdomen-pelvis será necessária após o diagnóstico de câncer pancreático para estadiamento; uma tomografia PET-CT pode ser justificada naqueles com doença localizada na tomografia computadorizada que farão o tratamento do câncer
A ultrassom endoscópico (EUS) pode ser usado posteriormente para guiar a biópsia por aspiração de agulha fina, a fim de avaliar histologicamente a lesão, se o diagnóstico ainda não estiver claro. A CPRE também pode ser usada para acessar a lesão para biópsia ou citologia, se em um local adequado*.
*Uma escovação biliar para citologia se a CPRE estiver sendo usada para aliviar a obstrução biliar e não houver diagnóstico tecidual.
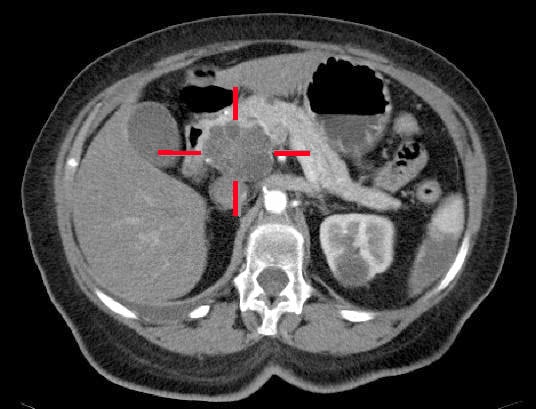 Figura 2 – Um adenocarcinoma localizado na cabeça do pâncreas, identificado na tomografia computadorizada
Figura 2 – Um adenocarcinoma localizado na cabeça do pâncreas, identificado na tomografia computadorizadaGestão
Cirurgia
A única opção de tratamento curativo atualmente é a ressecção radical:
- Para pacientes com tumores da cabeça do pâncreas, a cirurgia com intenção curativa mais comum é a pancreaticoduodenectomia, também conhecida como Whipple’s procedure
- Pilorus-preserving resections pode ser tentada em certos casos
- Para pacientes com tumores do corpo ou cauda do pâncreas, uma pancreatectomia distal pode frequentemente ser realizada
Contra-indicações absolutas para cirurgia incluem peritoneais, hepáticas e metástases distantes. Há uma alta morbidade associada a esses procedimentos (até 40%) e complicações específicas incluem formação de fístula pancreática, esvaziamento gástrico tardio e insuficiência pancreática.
Uma revisão da Cochrane descobriu que a ressecção pancreática aumenta a sobrevida e reduz os custos em comparação com tratamentos paliativos em pacientes com câncer pancreático localmente avançado e envolvimento venoso, assumindo que haja suficiente conhecimento clínico disponível.
Procedimento de Whipple
Um procedimento de Whipple envolve a remoção da cabeça do pâncreas, do antro do estômago, da 1ª e 2ª partes do duodeno, do ducto biliar comum e da vesícula biliar.
Todas as vísceras retiradas na operação são feitas devido ao seu suprimento arterial comum (a artéria gastroduodenal), compartilhado pela cabeça do pâncreas e o duodeno.
Segundo isto, a cauda do pâncreas e o ducto hepático são fixados ao jejuno, permitindo que a bílis e os sucos pancreáticos drenem para o intestino, enquanto que o estômago é anastomosado posteriormente com o jejuno permitindo a passagem dos alimentos.
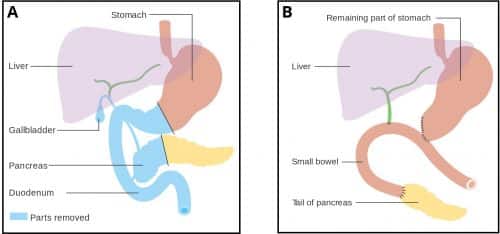 Figura 3 – Pancreaticoduodenectomia (procedimento de Whipple). A: Pré-procedimento, B: Pós-procedimento
Figura 3 – Pancreaticoduodenectomia (procedimento de Whipple). A: Pré-procedimento, B: Pós-procedimento
Chemoterapia
Quimioterapia juvante, geralmente com 5-flourouracil, é recomendada após a cirurgia, pois foi demonstrado que melhora a sobrevida após o ensaio ESPAC-1*.
Na doença metastática o uso de FOLFIRINOX regime (ácido folínico, 5-fluorouracil, irinotecano e oxaliplatina) é aconselhado naqueles com bom estado de desempenho, no entanto, produziu apenas melhorias modestas na sobrevida; a terapia com gemcitabina pode ser considerada para pessoas com câncer pancreático localmente avançado que não estão bem o suficiente para tolerar FOLFIRINOX.
*ESPAC-1 também demonstrou que pacientes tratados com quimioradioterapia adjuvante tiveram resultados globais piores do que aqueles tratados apenas com quimioterapia adjuvante.
Cuidados Paliativos
A maioria dos pacientes com câncer do pâncreas não são candidatos a cirurgia curativa, mas requerem envolvimento de cuidados paliativos.
A icterícia obstrutiva e a prurite associada podem ser aliviadas com a inserção de um stent biliar, seja via ERCP ou percutaneamente.
Quimioterapia paliativa, como com um regime baseado em gemcitabina, pode ser testada em pacientes com um estado de desempenho razoável.
Insuficiência exócrina é comum na doença avançada ou naqueles que tiveram excisão significativa do pâncreas, levando a má absorção e esteatorreia; esta pode ser inicialmente tratada com substituições enzimáticas (incluindo lipases), como Creon®.
Prognóstico
Câncer pancreático tem uma alta capacidade metastática mesmo em tumores pequenos. O prognóstico no câncer pancreático permanece muito pobre, com uma taxa de sobrevivência global de 5 anos <5%.
Key Points
- Câncer do pâncreas freqüentemente se apresentará com uma combinação de icterícia obstrutiva, dor abdominal ou perda de peso
- A maioria dos casos é inicialmente detectada na tomografia computadorizada, porém requer diagnóstico tecidual através de biópsia; CA19-9 é um marcador tumoral usado para monitorar a progressão da doença
- O tratamento definitivo é a ressecção cirúrgica, frequentemente com quimioterapia adjuvante
- Câncer pancreático tem uma taxa de sobrevivência de 5 anos inferior a 5%
Tumores endócrinos do pâncreas
Tumores endócrinos do pâncreas podem ser funcionais ou não funcionais. Os tumores funcionais secretam hormônios ativamente e seus sinais e sintomas estão relacionados a isso, enquanto os tumores não funcionais não secretam hormônios ativos e as características clínicas estão relacionadas puramente à sua disseminação maligna.
Tumores endócrinos do pâncreas estão frequentemente associados à síndrome de neoplasia endócrina múltipla 1 (MEN1); o MEN1 consiste tipicamente de hiperparatiroidismo, tumores endócrinos do pâncreas e tumores pituitários (mais comumente prolactinomas).
Características clínicas
| Tipo de célula | Hormônio decretado (nome do tumor) | Função fisiológica normal | Características do Tumor Funcional |
| Células G | Gastrin (gastrinoma) | Estimula a libertação de ácido gástrico | Zollinger-Síndrome de Ellison, resultando em úlceras pépticas graves, refratárias ao tratamento médico, com diarreia e esteatorreia |
| α Cells | Glucagon (Glucagonoma) | Concentração da glicemia aumentada | Hiperglycaemia, diabetes mellitus, e eritema migratório necrótico |
| β Células | Insulina (insulinoma) | Diminuir a concentração de glicose no sangue | Hipoglicemia sintomática, como o suor ou alteração do estado mental, melhorando com o consumo de carboidratos |
| δ Cells | Somatostatin (Somatostatinoma) | Inibe a libertação de GH, TSH e prolactina da hipófise anterior, e de gastrina | Diabetes mellitus, esteatorreia, cálculos biliares (devido à inibição da colecistoquinina), perda de peso, e acloridrina (devido à inibição da gastrina) |
| Células não ilhotas | Peptídeo intestinal vasoativo (VIPoma) | Secreção de água e eletrólitos no intestino. Relaxamento do músculo liso entérico. | Diarréia aquosa profusa e prolongada, hipocalemia grave e desidratação (também conhecida como síndrome de Verner-Morrison) |
Tabela 1 – Tumores endócrinos do pâncreas
Investigação
Todos os casos devem ser discutidos em uma reunião de equipe multidisciplinar onde o manejo possa ser orientado. Alguns exames de sangue podem ser enviados, dependendo do subtipo suspeito (Tabela 1)
As redes pancreáticas são melhor investigadas com uma combinação de tomografia computadorizada, ressonância magnética e/ou ultra-som endoscópico. O cálcio intra-arterial com angiografia de subtração digital também pode ser utilizado na localização e avaliação de insulinomas e gastrinomas.
Gerenciamento
Pancreáticas pequenas redes pancreáticas não funcionais bem diferenciadas (<1cm) podem ser simplesmente observadas. Tumores maiores ou funcionais são ressecados, com qualquer doença metastática distante também ressecada se o tumor for de grau baixo e as metástases de baixo volume.
Análogos de somatostatina podem ser usados para controlar e melhorar os efeitos da hipersecreção hormonal (mesmo no caso de somatostatinomas).