O elemento químico hélio é classificado como um gás nobre e um não-metal. Foi descoberto em 1895 por William Ramsay.

Zona de dados
| Classificação: | Hélio é um gás nobre e não metálico |
| Cor: | Sem cor |
| Peso atómico: | 4.00260 |
| Estado: | Gás: |
| Ponto de fusão: | -272.2 oC, 0.95 K |
| Nota: À pressão atmosférica normal, o hélio não solidifica e por isso não tem ponto de fusão. O ponto de fusão citado acima está sob uma pressão de 25 atmosferas. | |
| Ponto de fusão: | -268.9 oC, 4.2 K |
| Electrões: | 2 |
| Protões: | 2 |
| Neutrons no isótopo mais abundante: | 2 |
| Conchas de elétron: | 2 |
| Configuração de elétron: | 1s2 |
| Densidade @ 20oC: | 0.0001787 g/cm3 |
Mostrar mais, incluindo: Aquecimento, Energias, Oxidação,
Reações, Compostos, Raios, Condutividades
| Volume atômico: | 27,2 cm3/mol |
| Estrutura: | geralmente hexagonal fechado |
| (v.alta pressão necessária para solidificar hélio) | |
| Capacidade térmica específica | 5,193 J g-1 K-1 |
| Calor de fusão | 0.0138 kJ mol-1 |
| Calor de atomização | 0 |
| Calor de vaporização | 0.0845 kJ mol-1 |
| 1ª energia de ionização | 2372.3 kJ mol-1 |
| 2ª energia de ionização | – |
| 3ª energia de ionização | – |
| afinidade electrónica | 0 kJ mol-1 |
| Número mínimo de oxidação | 0 |
| Mín. oxidação comum no. | 0 |
| Número máximo de oxidação | 0 |
| Número máximo de oxidação comum. | 0 |
| Electronegatividade (Escala de Paulagem) | – |
| Volume de polarização | 0.198 Å3 |
| Reacção com ar | nenhum |
| Reacção com 15 M HNO3 | nenhum |
| Reacção com 6 M HCl | nenhum |
| Reacção com NaOH 6 M | nenhum |
| Óxido(s) | nenhum |
| Hidreto(s) | nenhum |
| Cloreto(s) | nenhum |
| Raio atómico | 31 pm |
| Raio iónico (1+ião) | – |
| Raio iónico (2+ião) | – |
| Raio iónico (3+ião) | – |
| Raio iónico (1- ião) | – |
| Raio iónico (2-ião) | – |
| Raio iónico (3-ião) | – |
| Condutividade térmica | 0.15 W m-1 K-1 |
| Condutividade eléctrica | – |
| Ponto de congelação/congelação: | -272.2 oC, 0.95 K |

Nasa: Os átomos de hélio ionizados a cerca de 60.000 °C na cromosfera do Sol emitem a luz ultravioleta vista nesta imagem.
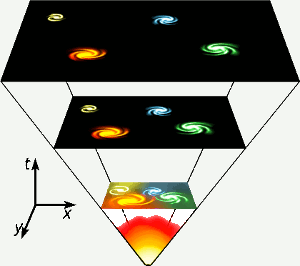
Helium foi feito nos primeiros três minutos de existência do universo, quando as temperaturas em todos os lugares eram altas o suficiente para que a fusão nuclear ocorresse. Esta fase curta e de alta energia está representada na parte inferior do diagrama. O hélio também é feito pela fusão nuclear de hidrogênio em estrelas como a nossa. Imagem: Gnixon
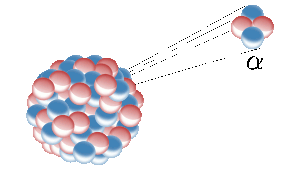
Helium on earth vem da fissão nuclear de elementos radioactivos como o urânio. Aqui um núcleo radioativo emite um núcleo de hélio (também conhecido como uma partícula alfa). Imagem: Inductiveload

Elium com linha amarela proeminente. Imagem: Nasa

William Ramsay apontando para a coluna final da tabela periódica contendo os gases nobres (ou inertes). Ramsay recebeu o Prémio Nobel da Química em 1904 pelo seu trabalho na descoberta dos gases inertes. Imagem: Vanity Fair
Descoberta do Hélio
A história da descoberta do hélio está entrelaçada com a descoberta da natureza das estrelas.
Em tempos, as pessoas acreditavam que nunca saberíamos de que são feitas as estrelas. Em 1835, o filósofo francês Auguste Comte declarou: “Nunca poderemos de forma alguma estudar a sua composição química”. (1)
Comte pensou que só podíamos aprender o que era a matéria estrelada se a conseguíssemos levar para o laboratório.
Apesar do pessimismo de Comte, o método para a descoberta do hélio e das composições das estrelas já tinha sido encontrado. Em 1814, o físico alemão Joseph Fraunhofer tinha tomado o método de Isaac Newton de dividir a luz solar usando um prisma e tinha feito um avanço crucial. Fraunhofer tinha notado linhas escuras no arco-íris de cores vindas da luz solar dividida por um prisma; as linhas que ele viu foram a primeira observação de sempre do espectro de uma estrela. (2), (3)
Em 1859/60 os cientistas alemães Gustav Kirchhoff e Robert Bunsen deram enormes saltos na ciência da espectroscopia, incluindo a descoberta de que as linhas escuras que Fraunhofer tinha visto eram como as impressões digitais de uma substância.
A cena foi marcada para Kirchhoff e Bunsen descobrirem novos elementos estudando a luz a partir de substâncias quando estavam queimando.
Em 1860 eles descobriram o césio pelas suas linhas espectrais azuis e em 1861 o rubídio a partir de duas linhas espectrais vermelhas. Então William Crookes descobriu o tálio em 1861 após observar uma linha espectral verde brilhante.
Kirchhoff e Bunsen olharam para o espectro do sol e foram capazes de concluir que o ferro estava presente na sua atmosfera incandescente. (4)
Para a descoberta do hélio, foram necessários mais alguns anos. Em agosto de 1868 o primeiro eclipse total desde a publicação do trabalho de Kirchhoff e Bunsen era devido.
O astrônomo francês Pierre Janssen estava esperando por um eclipse para observar proeminências na corona do sol usando um espectroscópio. Nas duas semanas seguintes ao eclipse Janssen desenvolveu um método de gravação de espectros de proeminências sem a necessidade de um eclipse. Nesses espectros, ele observou uma linha amarela. (5)
A linha estava numa posição similar mas não idêntica às linhas no espectro do sódio. Estas foram chamadas de linhas D1 e D2. O cientista inglês Norman Lockyer estudou a nova linha amarela; mais tarde ela seria chamada de linha D3. Ele publicou seu estudo da linha, ciente de que ela poderia ser causada por um novo elemento:
“…então sabíamos que não estávamos lidando com hidrogênio; portanto, tínhamos a ver com um elemento que não podíamos obter em nossos laboratórios, e por isso assumi a responsabilidade de cunhar a palavra hélio, em primeira instância para uso laboratorial”. (6)
O nome hélio veio da palavra grega para o sol, helios.
Lockyer e Edward Frankland, seu colega de trabalho, tinha uma série de outras idéias sobre as possíveis causas da linha amarela e, portanto, não anunciou um novo elemento.
Em 1871, outros cientistas estavam cientes da situação. Lord Kelvin discutiu “o reflexo da luz do hidrogênio incandescente e ‘hélio’ ao redor do sol”. O uso do ‘hélio’ é seguido por uma nota de rodapé para explicar:
“Frankland e Lockyer encontram as proeminências amarelas para dar uma linha brilhante muito decidida não muito longe de D, mas até agora não identificada com nenhuma chama terrestre. Parece indicar uma nova substância, que eles propõem chamar de Hélio”. (7)
A existência do Hélio não foi, no entanto, aceita por todos. (5)
Todas as dúvidas foram dissipadas quando o químico escocês William Ramsay isolou hélio em 1895 em Londres. Ramsay tinha codescoberto o árgon em 1894; o árgon foi o primeiro dos gases nobres a ser descoberto. Em 1895 ele leu um artigo de William Hillebrand descrevendo um gás não reativo que foi liberado quando o ácido foi adicionado ao mineral urânio, o uranito. Hillebrand acreditava que o gás era nitrogênio.
Ramsay, que acreditava que o gás poderia conter argônio, repetiu a experiência de Hillebrand usando outro mineral de urânio, o cleveite, e coletou o gás.
Seu espectroscópio indicava a presença de nitrogênio, argônio e um outro gás. Ramsay suspeitou que poderia ser hélio, porque parecia haver uma linha D3. (8) Consciente de que Lockyer e William Crookes tinham um espectroscópio melhor que o dele, ele enviou a eles uma amostra do gás. Infelizmente a amostra não era adequada, então Lockyer obteve uma amostra de uranita, extraiu o gás e estudou-o por espectroscópio. Ele escreve: (8)
“Uma a uma as linhas desconhecidas que eu tinha observado no sol em 1868 foram encontradas como pertencentes ao gás.”
“O espectro do gás era idêntico ao do ‘hélio’ do sol. Um novo elemento ganhou o seu lugar na tabela periódica.
Visit Chemicool’s Cool Helium Facts Page.

Aspecto e Características
Efeitos nocivos:
Hélio não é conhecido por ser tóxico.
Características:
O hélio é um gás leve, inodoro, incolor, inerte e monatómico. Pode formar moléculas diatómicas, mas apenas de forma fraca e a temperaturas próximas do zero absoluto.
O hélio tem o ponto de fusão mais baixo de qualquer elemento e o seu ponto de ebulição está próximo do zero absoluto.
Ao contrário de qualquer outro elemento, o hélio não solidifica, mas permanece um líquido até ao zero absoluto (0 K) sob pressões normais.
A voz de alguém que tenha inalado hélio temporariamente soa agudo.
Usos de Hélio
A ressonância magnética (MRI) é o maior utilizador de hélio. O hélio é usado para resfriar os ímãs supercondutores da ressonância magnética dos scanners.
O hélio é usado para encher balões (blimps) e para pressurizar foguetes de combustível líquido.
Misturas de hélio e oxigênio são usadas como um ‘ar’ artificial para mergulhadores e outros que trabalham sob pressão. O hélio é usado em vez do nitrogênio no ar normal porque, após um mergulho longo, o hélio deixa o corpo mais rápido que o nitrogênio, permitindo uma descompressão mais rápida.
O hélio é usado como um escudo de gás nas proximidades da soldagem por arco evitando, por exemplo, qualquer reação de soldas de metal quente com oxigênio. O gás é utilizado na indústria de semicondutores para fornecer uma atmosfera inerte para o crescimento de cristais de silício e de germânio. Também é utilizado como gás de alta temperatura na produção de titânio e zircônio, e como gás portador na cromatografia gasosa.
Abundância e isótopos
Abundância da crosta terrestre: 8 partes por bilhão em peso, 43 partes por bilhão em moles
Abundância do sistema solar: 23 % em peso, 7,4 % em moles
Custo, puro: $5,2 por 100g
Custo, a granel: $ por 100g
Fonte: Quase todo o hélio na Terra é o resultado da decadência radioactiva. As principais fontes de hélio são de depósitos de gás natural em poços no Texas, Oklahoma e Kansas. O hélio é extraído por destilação fracionada do gás natural, que contém até 7% de hélio.
Isótopos: O hélio tem 8 isótopos cuja meia-vida é conhecida, com números de massa de 3 a 10. O hélio natural é uma mistura dos seus dois isótopos estáveis, 3He e 4He com abundâncias naturais de 0,0001% e 99,999% respectivamente.

- Auguste Comte, Cours de Philosophie Positive at Project Gutenberg
- Keith J. Laidler, The World of Physical Chemistry, 1993, p179.
- The Era of Classical Spectroscopy, do MIT Spectroscopy.
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics., 1984, Elsevier Science Publishers, p211
- Helge Kragh, The Solar Element: A Reconsideration of Helium’s Early History, 2009, Annals of Science, 66:2, p157-182.
- J. Norman Lockyer, The Growth of our Knowledge of Helium, Science Progress, 1896, Vol 5., p249
- W. Thomson, Discurso Presidencial, Associação Britânica para o Progresso da Ciência, 1871, (Endereço. XCIX).
- Sir Norman Lockyer, O Lugar do Sol na Natureza.., 1897, p47-48
Cite esta Página
Para ligação online, por favor copie e cole um dos seguintes:
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
ou
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
Para citar esta página num documento académico, por favor use a seguinte citação compatível com a MLA:
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.