Em química, a geometria molecular em forma de T descreve as estruturas de algumas moléculas onde um átomo central tem três ligandos. Normalmente, os compostos tricordenados adotam geometrias trigonais planares ou piramidais. Exemplos de moléculas em forma de T são os trifluoretos halogenados, como o ClF3.
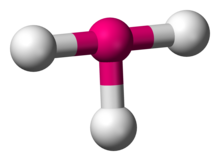
ClF3
C2v
90°, 180°
>0

De acordo com a teoria VSEPR, a geometria em forma de T resulta quando três ligandos e dois pares solitários de electrões estão ligados ao átomo central, escritos na notação AXE como AX3E2. A geometria em forma de T está relacionada com a geometria molecular bipiramidal trigonal para moléculas AX5 com três ligandos equatoriais e dois axiais. Em uma molécula AX3E2, os dois pares isolados ocupam duas posições equatoriais, e os três átomos ligandos ocupam as duas posições axiais, bem como uma posição equatorial. Os três átomos ligam-se em ângulos de 90° de um lado do átomo central, produzindo a forma em T.
O ânion trifluoroxenato(II), XeF-
3, foi investigado como um possível primeiro exemplo de uma molécula AX3E3, que poderia ser esperado pelo raciocínio VSEPR ter seis pares de elétrons em um arranjo octaédrico com ambos os três pares solitários e os três ligandos em uma orientação mer ou em forma de T. Embora este ânion tenha sido detectado na fase gasosa, as tentativas de síntese em solução e determinação experimental da estrutura não foram bem sucedidas. Um estudo químico computacional mostrou uma geometria plana distorcida em Y com o menor ângulo de ligação F-Xe-F igual a 69°, ao invés de 90° como em uma geometria em forma de T.