Alguns átomos são mais polares que outros devido ao facto de serem mais “gananciosos” pelos electrões.
Dê uma vista de olhos à tua tabela periódica, quanto mais direito e para cima vais, mais átomos electrónicos se tornam (não incluindo os gases nobres porque têm conchas cheias e são “felizes” e não precisam de nenhum electrão de valência).
Penso que todos já ouviram dizer que a Flourina (F), por exemplo, é um dos elementos mais electronegativos, irá literalmente rasgar electrões de átomos de Hidrogénio ou átomos de carbono. Assim como o Cloro (Cl)
Verifica esta imagem:
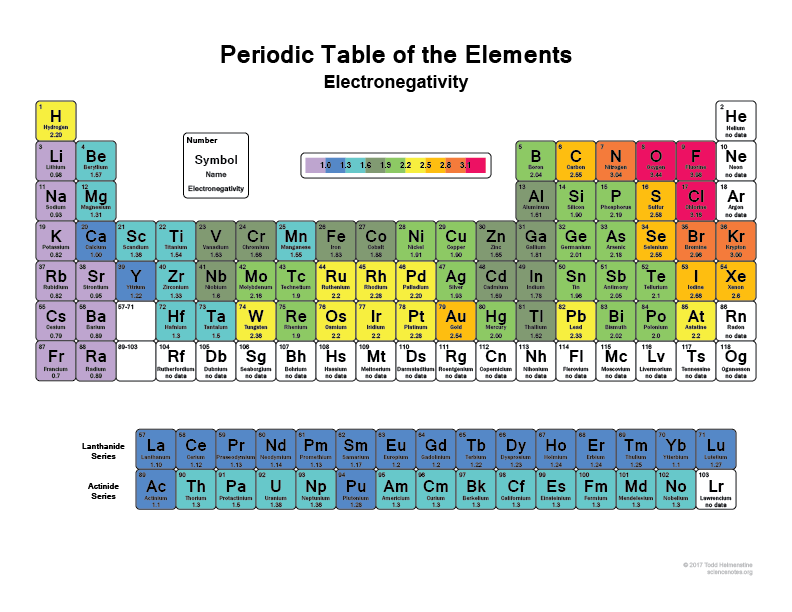
É por isso que quando uma ligação algumas moléculas têm regiões super polares porque têm algo como a ligação do Hidrogénio com algo como a Farinha que basicamente tem os electrões com ela a maior parte do tempo.
Esta questão também pode ser explicada pela ideia de nuvens de electrões e pelo facto de que mais átomos de electrões negativos terão normalmente mais electrões a permanecerem com ele a maior parte do tempo, em comparação com os átomos de electrões não tão negativos.

Chama-se a isto o momento dipolo e sem entrar muito nele vê-se como a maioria dos electrões estão mais próximos do Oxigénio do que do Hidrogénio (porque o Oxigénio é mais electronegativo do que o Hidrogénio)
Pela forma como a palavra electronegativo soa por vezes contra-intuitiva mas a sua electro-negativa em vez de positiva porque nos átomos químicos que ganham electrões têm um sinal negativo (Ex: #Cl^-# é um cloro que ganhou um electrão).