Os termos; luminescência, fotoluminescência, fluorescência e fosforescência são usados rotineiramente em trabalhos de pesquisa para descrever a emissão de luz a partir de uma amostra. Este nome múltiplo pode ser confundido com vários dos termos utilizados de forma intercambiável e pesquisadores de diferentes formações científicas preferem usar um nome em vez de outro. Neste artigo respondemos à pergunta “Qual é a diferença entre Luminescência, Fotoluminescência, Fluorescência e Fosforescência”.
- O que é Luminescência?
- O que é fotoluminescência?
- Qual é a diferença entre fluorescência e fosforescência?
- Produtos para Luminescência, Fotoluminescência, Fluorescência e Fosforescência
- Se você gostou de ler este artigo, e gostaria de ser o primeiro a ver todas as últimas notícias, aplicações e informações de produtos da Edinburgh Instruments, então inscreva-se em nossa newsletter pouco freqüente através do botão vermelho abaixo, e siga-nos nas mídias sociais.
O que é Luminescência?
Luminescência é qualquer emissão de luz (ondas eletromagnéticas) de uma substância que não surge do aquecimento. Esta definição torna a luminescência distinta da incandescência que é a emissão de luz devido à temperatura elevada de uma substância, como uma brasa cintilante. A palavra luminescência é derivada da palavra latina para luz, lumen, e do latim, escentia, que significa ‘o processo de’ e, portanto, é o processo de emitir luz.

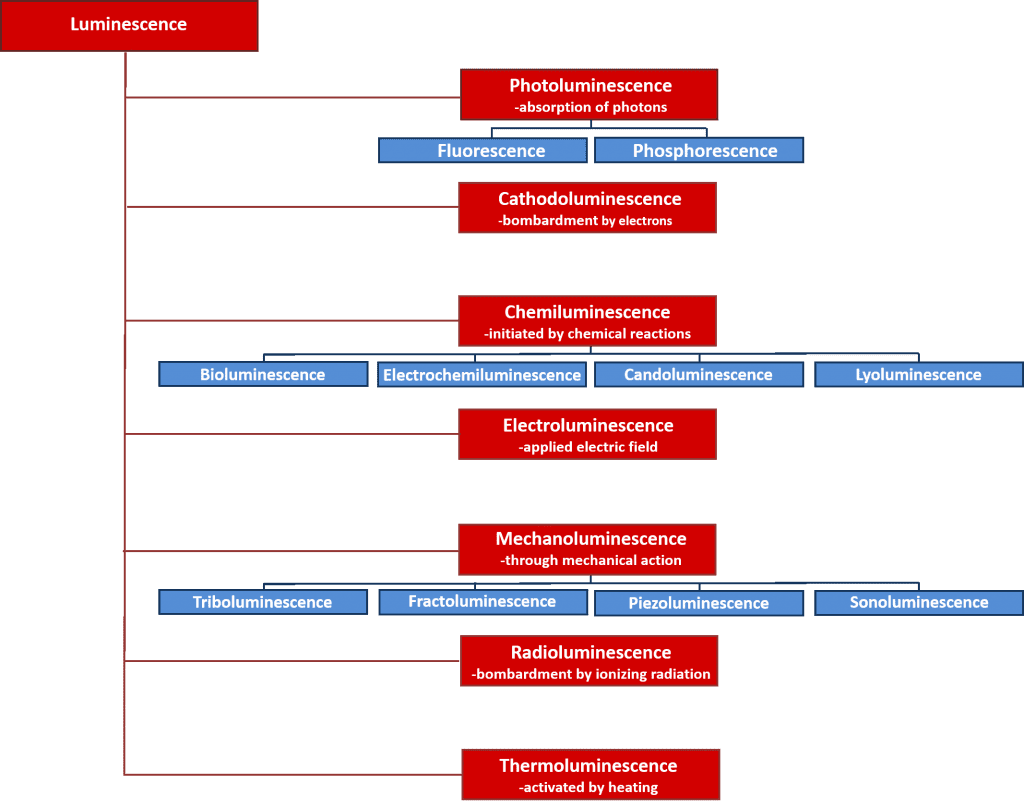
Há muitos tipos de luminescência que podem ser classificados pela fonte de energia que inicia o processo de luminescência. Uma visão geral dos vários tipos de luminescência e suas fontes de energia é dada na Figura 2. Muitos destes processos de luminescência têm importantes aplicações científicas e industriais como a electroluminescência onde a luz é emitida após a recombinação de electrões e furos após a aplicação de um campo eléctrico sobre um material, e é o princípio de funcionamento por detrás dos díodos emissores de luz; e a quimioluminescência onde a emissão de luz é iniciada por uma reacção química e utilizada em ensaios biológicos e é responsável pelo brilho dos paus luminosos. Contudo, o foco deste artigo é a fotoluminescência, que constitui a base da poderosa técnica não destrutiva espectroscópica, a fotoluminescência espectroscópica, que é amplamente utilizada tanto na academia como na indústria.
O que é fotoluminescência?
Fotoluminescência é a emissão de luz de um material após a absorção da luz. A palavra em si mesma é interessante por ser a combinação da palavra derivada do latim luminescência e do prefixo grego, foto-, para luz. Qualquer luminescência que seja induzida pela absorção de fótons é chamada fotoluminescência. Isto poderia igualmente ser emissão de luz de uma molécula de corante orgânico em solução (Figura 3a), ou recombinação banda a banda de elétrons e furos após fotoexcitação de um semicondutor (Figura 3b).

Descrevendo qualquer emissão de luz induzida por absorção de fótons como fotoluminescência é preciso; entretanto, é prática comum, particularmente por químicos, subdividir ainda mais a fotoluminescência em fluorescência e fosforescência.
Qual é a diferença entre fluorescência e fosforescência?
Existem várias definições de fluorescência e fosforescência, sendo a mais simples que a fluorescência é a fotoluminescência imediata que ocorre muito pouco tempo após a fotoexcitação de uma substância, enquanto a fosforescência é a fotoluminescência de longa duração que continua muito tempo após a fotoexcitação ter cessado. Embora esta seja uma definição simples, não explica porque ocorre tal diferença nas escalas de tempo da fotoluminescência e alguns materiais podem cair numa área cinzenta entre as escalas de tempo clássicas da fluorescência e da fosforescência. Uma definição mais detalhada tem que ser baseada na mecânica quântica dos estados excitados e do solo envolvidos no processo de emissão. Usando esta abordagem a fluorescência e a fosforescência podem ser definidas como fotoluminescência onde a transição radiativa não requer uma mudança na multiplicidade de spin e fotoluminescência onde a transição radiativa envolve uma mudança na multiplicidade de spin respectivamente.
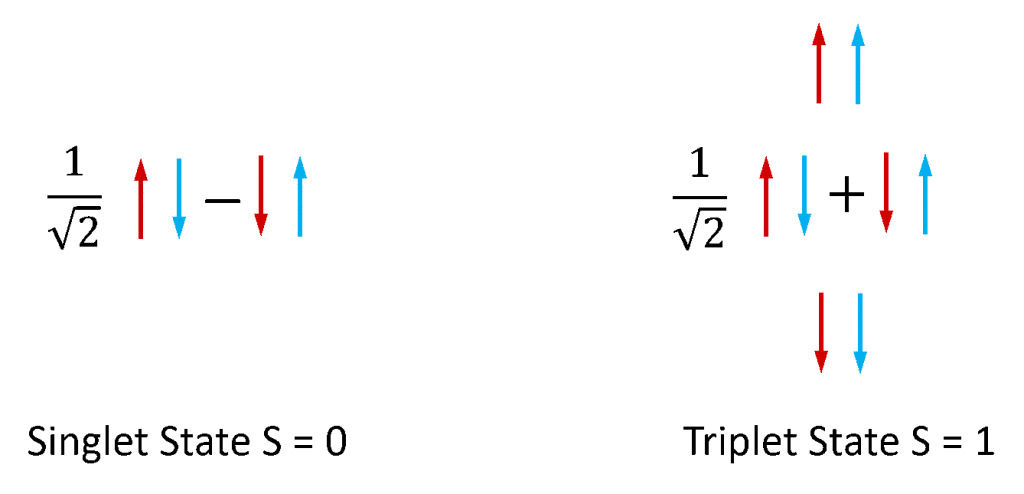
Fluorescência e fosforescência são mais comumente usadas para se referir à fotoluminescência de sistemas moleculares. Os elétrons em moléculas estáveis sempre existem em pares, já que as moléculas com elétrons não pareados são extremamente reativas e instáveis. Os elétrons possuem um momento angular intrínseco conhecido como ‘spin’ e um par de elétrons pode existir em um dos dois estados de spin total, dependendo da simetria relativa dos spins dos dois elétrons. Se as duas giros estão numa configuração antissimétrica o par de electrões tem um spin total de zero (S = 0) enquanto que se estão numa configuração simétrica então o par tem um spin total de um (S = 1). Como ilustrado na Figura 4, existe uma combinação de estados de par de spin eletrônico que é antissimétrica e três combinações de estados de par de spin que são simétricos e os estados S = 0 e S = 1 são portanto chamados de singlet e triplet respectivamente.
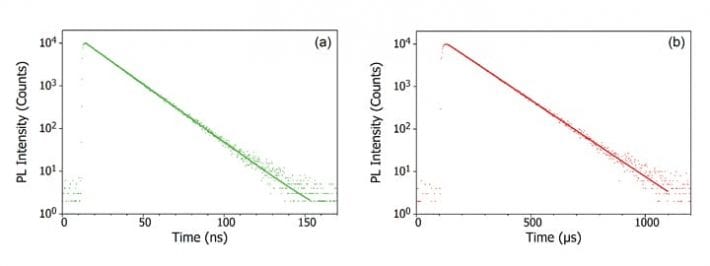
Quando um fóton é absorvido pela molécula, um dos elétrons é promovido a um nível de energia mais elevado e a molécula está agora em estado excitado. O estado do solo de uma molécula é (quase) sempre um estado singlet (S0) e devido à conservação do momento angular o estado fotoexcitado também deve ser um singlet (S1) como mostra o diagrama de Jablonski abaixo. A decadência do estado S1 de volta ao S0 é uma transição permitida (uma vez que ambos os estados têm a mesma multiplicidade de spin) resultando em fotoluminescência imediata que ocorre na escala de tempo picossegundos para nanossegundos e é chamada de fluorescência.
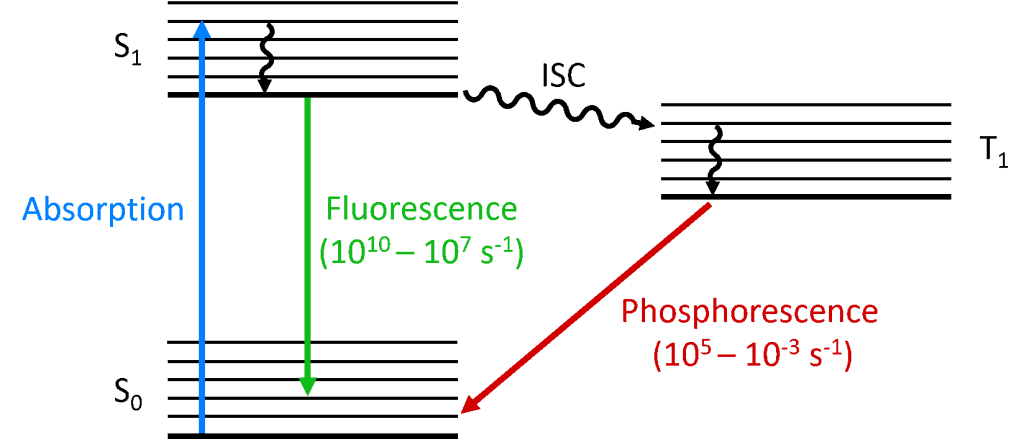
Alternativamente a molécula pode ser submetida ao cruzamento inter-sistemas (ISC) para o estado trigêmeo excitado (T1). O ISC ocorre tipicamente em moléculas com um alto grau de acoplamento spin-orbit, o acoplamento do momento angular orbital e o momento angular spin do elétron, o que permite a conversão entre os estados singlet e triplet. A força de acoplamento spin-orbit aumenta com a massa do átomo, pelo que as moléculas fosforescentes devem conter metais pesados como o europium e o irídio. A decadência do estado T1 de volta ao S0 é uma transição proibida, uma vez que os estados têm diferentes multiplicidades de spin, devido à conservação do momento angular. No entanto, o acoplamento spin-orbit relaxa esta restrição e torna-se possível uma transição radiativa do estado T1 para o S1. Como é ‘proibida’ a fotoluminescência que resulta da transição de T1 para S0 ocorre em uma escala de tempo muito mais lenta, de microssegundos a milhares de segundos, e é chamada de fosforescência.
Deve-se notar também que a emissão de alguns materiais nem sempre se enquadra perfeitamente em uma ou outra categoria. Um exemplo disso é a fluorescência retardada termicamente ativada (TADF). No TADF os níveis S1 e T1 estão próximos em energia e fortemente acoplados, sendo portanto possível inverter a ISC do T1 para o S1. Isto dá origem a uma transição retardada de S1 para S0 que resulta em fotoluminescência a uma escala de tempo entre a fluorescência e a fosforescência, conhecida como fluorescência retardada. Para mais informações sobre TADF e seu uso em OLEDs de alta eficiência, leia o post em ‘O que é TADF?’.
Quando descrever a emissão como fotoluminescência versus fluorescência/fosforescência é, em última instância, uma preferência pessoal. Químicos e biólogos, que estudam principalmente sistemas moleculares, favorecem o uso da fluorescência e da fosforescência, uma vez que nestes sistemas moleculares altamente localizados existem estados singlet e triplet distintos. Em contraste, os físicos estudam predominantemente materiais semicondutores onde os elétrons são altamente deslocalizados e o conceito de singlet e triplet frequentemente deixa de ser relevante. Esta é uma das razões pelas quais os físicos tendem a usar o termo mais amplo fotoluminescência para descrever a emissão de luz.
O que quer que você decida chamá-la; fotoluminescência, fluorescência e fosforescência podem fornecer uma riqueza de informações sobre as propriedades das moléculas e materiais; desde a determinação da vida útil do portador de carga em células solares até a medição da dinâmica de solvatação em torno de micelas em células vivas.
Produtos para Luminescência, Fotoluminescência, Fluorescência e Fosforescência
Para medir fotoluminescência é necessário um espectrómetro de fotoluminescência e a Edinburgh Instruments oferece uma gama de espectrómetros de fotoluminescência com contagem de fotões simples para medir espectros de fotoluminescência, tempo de vida, anisotropia e rendimentos quânticos das suas amostras.