Tanulási célok
- Magyarázza meg, miért magasabb az alkoholok forráspontja, mint a hasonló moláris tömegű étereké és alkánoké.
- Magyarázza meg, miért oldódnak vízben a négy vagy kevesebb szénatomos alkoholok és éterek, míg a hasonló alkánok nem oldódnak.
Az alkoholok a víz (H2O; más írásmóddal HOH) származékainak tekinthetők.

A víz H-O-H kötéséhez hasonlóan az R-O-H kötés is hajlított, és az alkoholmolekulák polárisak. Ez a kapcsolat különösen a kis molekuláknál figyelhető meg, és tükröződik a kis moláris tömegű alkoholok fizikai és kémiai tulajdonságaiban. Ha egy alkán hidrogénatomját OH-csoporttal helyettesítjük, a molekulák hidrogénkötésen keresztül kapcsolódhatnak (\(\PageIndex{1}\) ábra).
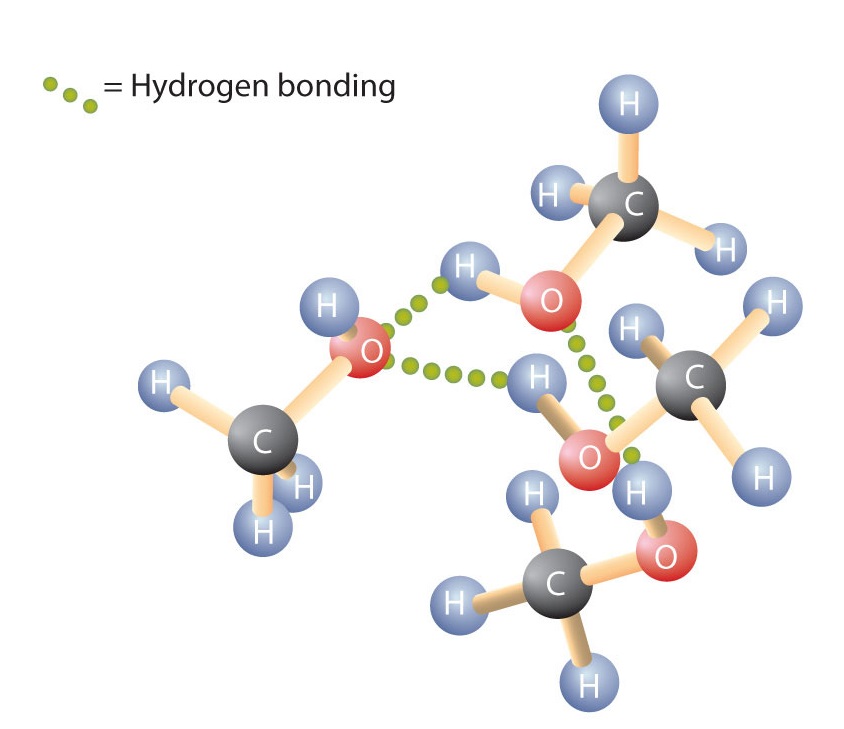
Emlékezzünk arra, hogy a fizikai tulajdonságokat nagymértékben meghatározza a molekulák közötti erők típusa. A \(\PageIndex{1}\) táblázat néhány gyakori vegyület moláris tömegét és forráspontját sorolja fel. A táblázatból látható, hogy a hasonló moláris tömegű anyagok forráspontja igen eltérő lehet.
| CH4 | Szerkezet | Név | Moláris tömeg | Fulladási pont (°C) |
|---|---|---|---|---|
| CH4 | metán | 16 | -164 | |
| HOH | víz | 18 | 100 | |
| C2H6 | etán | 30 | -89 | |
| CH3OH | metanol | 32 | 65 | |
| C3H8 | propán | 44 | -42 | |
| CH3CH2OH | etanol | 46 | 78 | |
| C4H10 | bután | 58 | -1 | |
| CH3CH2CH2OH | 1- -propanol | 60 | 97 |
Az alkánok nem polárisak, így csak viszonylag gyenge diszperziós erők révén kapcsolódnak. Az egy-négy szénatomot tartalmazó alkánok szobahőmérsékleten gázok. Ezzel szemben még az egy szénatomos metanol is folyadék szobahőmérsékleten. A hidrogénkötés jelentősen megnöveli az alkoholok forráspontját a hasonló moláris tömegű szénhidrogénekhez képest. A forráspont egy durva mértékegysége annak, hogy mennyi energia szükséges ahhoz, hogy egy folyadékmolekula elváljon a legközelebbi szomszédaitól. Ha a molekulák hidrogénkötésen keresztül lépnek kölcsönhatásba egymással, akkor viszonylag nagy mennyiségű energiát kell bevinni ahhoz, hogy ezeket a molekulák közötti vonzásokat megszakítsuk. Csak ekkor tud a molekula a folyadékból gáz halmazállapotba lépni.
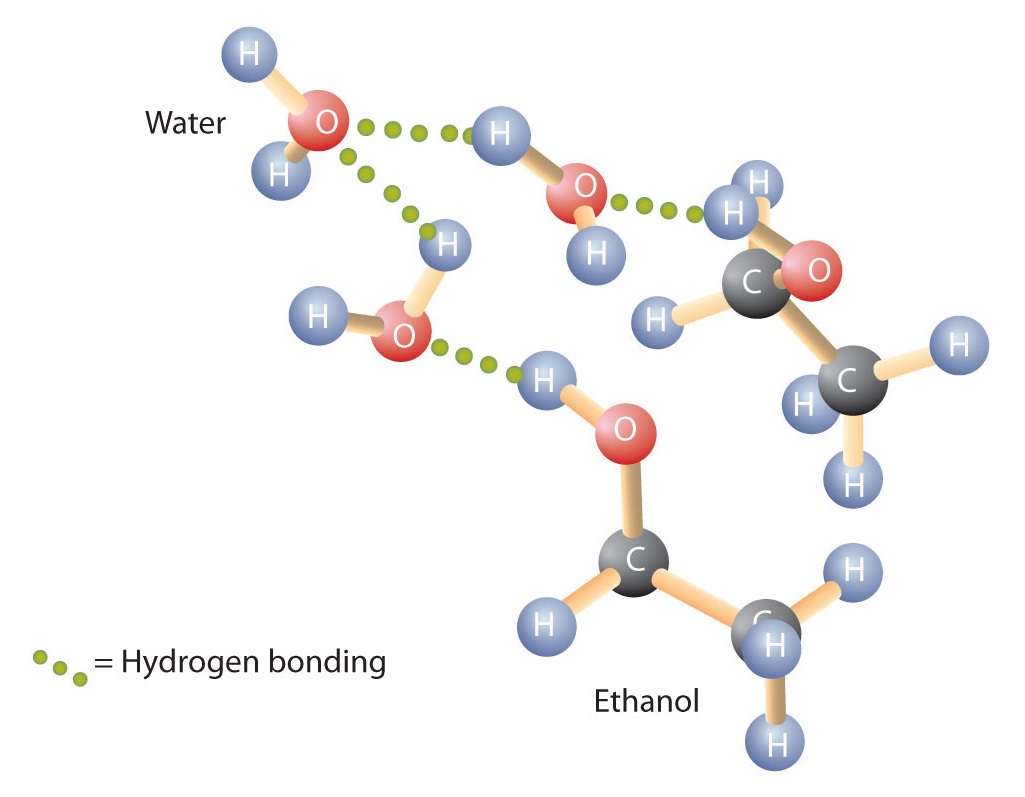
Az alkoholok is képesek hidrogénkötést létesíteni vízmolekulákkal (\(\(\PageIndex{2}\) ábra). Így míg a szénhidrogének vízben nem oldódnak, az egy-három szénatomot tartalmazó alkoholok teljesen oldódnak. A lánc hosszának növekedésével azonban az alkoholok vízben való oldhatósága csökken; a molekulák egyre inkább a szénhidrogénekre és egyre kevésbé a vízre hasonlítanak. Az 1-dekanol alkohol (CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2OH) lényegében nem oldódik vízben. Gyakran tapasztaljuk, hogy az oldhatóság határa a szerves vegyületek családjában négy vagy öt szénatomnál húzódik.
Összefoglaló
Az alkoholok forráspontja magasabb, mint a hasonló moláris tömegű étereké és alkánoké, mert az OH-csoport lehetővé teszi az alkoholmolekulák számára a hidrogénkötést. A négy vagy kevesebb szénatomos alkoholok vízben oldódnak, mert az alkoholmolekulák hidrogénkötést létesítenek a vízmolekulákkal; a hasonló alkánmolekulák nem tudnak hidrogénkötést létesíteni.
Koncepció áttekintő gyakorlatok
-
Miért oldódik az etanol jobban vízben, mint az 1-hexanol?
-
Miért alacsonyabb az 1-butanol forráspontja, mint az 1-hexanolé?
Válaszok
-
Az etanolnak van egy OH-csoportja és csak 2 szénatomja; az 1-hexanolnak 6 szénatomra egy OH-csoportja van, és így jobban hasonlít egy (nem poláris) szénhidrogénre, mint az etanol.
-
Az 1-hexanol moláris tömege nagyobb, mint az 1-butanolé.
GYakorlatok
Válaszoljon a következő feladatokra anélkül, hogy a szövegben található táblázatokat segítségül hívná.
-
Rendezze ezeket az alkoholokat a növekvő forráspont sorrendjében: etanol, metanol és 1-propanol.
-
Melyiknek magasabb a forráspontja – a butánnak vagy az 1-propanolnak?
-
Rendezze ezeket az alkoholokat a vízben való oldhatóság növekvő sorrendjében: 1-butanol, metanol és 1-oktanol.
-
Rendezze ezeket a vegyületeket a vízben való oldhatóságuk növekvő sorrendjében: 1-butanol, etanol és pentán.
Válaszok
-
metanol < etanol < 1-propanol
-
1-oktanol < 1-butanol < metanol