Entrópia
A természetben a rendszerek hajlamosak a nagyobb rendezetlenség vagy véletlenszerűség felé haladni. Az entrópia egy rendszer véletlenszerűségének vagy rendezetlenségének mértékegysége. Az entrópia könnyen érthető fogalom, ha mindennapi helyzetekre gondolunk. Egy nemrég kitakarított és rendezett szoba entrópiája alacsony. Ahogy telik az idő, valószínűleg egyre rendezetlenebbé válik, és így az entrópiája nőni fog (lásd az alábbi ábrát). Egy rendszer természetes tendenciája az entrópia növekedése.
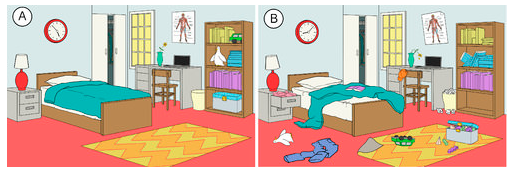
A kémiai reakciók is hajlamosak úgy lezajlani, hogy a rendszer teljes entrópiája növekedjen. Honnan tudod megállapítani, hogy egy bizonyos reakció az entrópia növekedését vagy csökkenését mutatja-e? A reaktánsok és a termékek molekuláris állapota ad bizonyos támpontokat. Az alábbi általános esetek az entrópiát molekuláris szinten szemléltetik.
- Egy adott anyag esetében a folyékony állapot entrópiája nagyobb, mint a szilárd állapot entrópiája. Hasonlóképpen a gáz entrópiája nagyobb, mint a folyadék entrópiája. Ezért az entrópia növekszik azokban a folyamatokban, amelyekben a szilárd vagy folyékony reaktánsok gáznemű termékeket képeznek. Az entrópia akkor is nő, amikor a szilárd reaktánsok folyékony termékeket képeznek.
- Az entrópia akkor nő, amikor egy anyag több részre bomlik. Az oldódás folyamata növeli az entrópiát, mert az oldott anyag részecskéi elválnak egymástól, amikor oldat keletkezik.
- A hőmérséklet növekedésével nő az entrópia. A hőmérséklet növekedése azt jelenti, hogy az anyag részecskéi nagyobb mozgási energiával rendelkeznek. A gyorsabban mozgó részecskéknek nagyobb a rendezetlensége, mint az alacsonyabb hőmérsékleten lassabban mozgó részecskéknek.
- Az entrópia általában azokban a reakciókban nő, amelyekben a termékmolekulák összlétszáma nagyobb, mint a reagáló molekulák összlétszáma. Kivételt képez ez alól az az eset, amikor gáz keletkezik nem gáznemű reaktánsokból.
Az alábbi példák azt szemléltetik, hogyan lehet megjósolni az entrópiaváltozást egy reakcióban.
\(\ce{Cl_2}) \left( g \right) \rightarrow \ce{Cl_2} \left( l \right)\)
Az entrópia csökken, mert a gázból folyadék lesz.
\(\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right)\)
Az entrópia növekszik, mert gáz keletkezik és a molekulák száma növekszik.
\(\ce{N_2} \left( g \right) + 3 \ce{H_2} \left( g \right) \rightarrow 2 \ce{NH_3} \left( g \right)\)
Az entrópia csökken, mert négy összes reaktáns molekulából két összes termékmolekula képződik. Mindegyikük gáz.
\(\ce{AgNO_3}) \left( aq \right) + \ce{NaCl} \left( aq \right) \rightarrow \ce{NaNO_3} \left( aq \right) + \ce{AgCl} \left( s \right)\)
Az entrópia csökken, mert a vizes reaktánsokból szilárd anyag képződik.
\(\ce{H_2} \left( g \right) + \ce{Cl_2} \left( g \right) \rightarrow 2 \ce{HCl} \left( g \right)\)
Az entrópiaváltozás ismeretlen (de valószínűleg nem nulla), mivel az egyenlet mindkét oldalán azonos számú molekula van, és mindegyik gáz.