Az atommodell
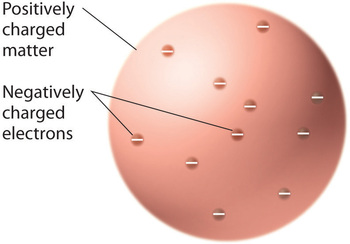
Amikor a tudósok megállapították, hogy minden anyag negatív töltésű elektronokat tartalmaz, világossá vált, hogy az elektromosan semleges atomoknak pozitív töltéseket is tartalmazniuk kell a negatív töltések ellensúlyozására. Thomson azt javasolta, hogy az elektronok egy egységes gömbbe ágyazódnak, amely tartalmazza mind a pozitív töltést, mind az atom tömegének nagy részét, hasonlóan a mazsolához a szilvapudingban vagy a csokoládéforgácshoz a süteményben (\(\PageIndex{9}\) ábra)
2.4.6
Ábra \(\PageIndex{9}\): Thomson szilvapuding vagy csokis süti modellje az atomról. Ebben a modellben az elektronok egy egyenletes pozitív töltésű gömbbe vannak ágyazva. A képet engedéllyel használjuk (CC BY-SA-NC).
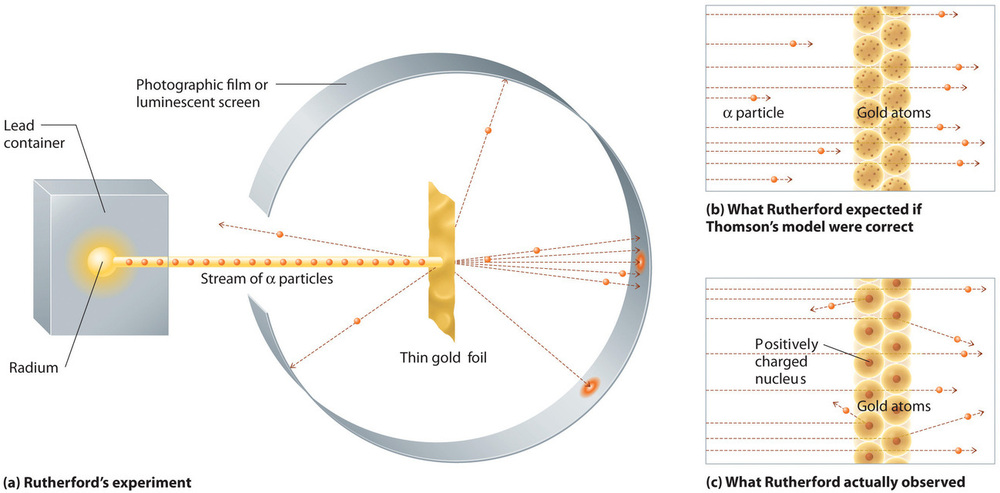
Rutherford azonban egyetlen híres kísérletben egyértelműen kimutatta, hogy Thomson atommodellje téves. Rutherford α-részecskék áramát irányította egy nagyon vékony aranyfóliás céltáblára (\(\PageIndex{10a}\) ábra), és megvizsgálta, hogyan szóródnak az α-részecskék a fólián. Az aranyat azért választották, mert könnyen lehetett rendkívül vékony lapokká kalapálni, így minimalizálva a céltárgyban lévő atomok számát. Ha Thomson atommodellje helyes lenne, akkor a pozitív töltésű α-részecskéknek úgy kellene átütniük az arany céltábla egyenletesen eloszló tömegét, mint az ágyúgolyók egy faház oldalát. Kicsit lassabban mozognak, amikor kilépnek, de lényegében egyenesen kell áthaladniuk a céltárgyon (\(\PageIndex{10b}\) ábra)Rutherford legnagyobb meglepetésére az α-részecskék egy kis része nagy szögben eltérült, és néhányuk közvetlenül visszaverődött a forráshoz (\(\(\PageIndex{10c}\) ábra). Rutherford szerint “Ez majdnem olyan hihetetlen volt, mintha egy 15 hüvelykes lövedéket lőttünk volna ki egy darab selyempapírra, és az visszajött volna és eltalált volna minket.”
2.4.7
Ábra \(\PageIndex{10}\): Rutherford kísérleteinek összefoglalása. (a) Annak a készüléknek az ábrázolása, amelyet Rutherford egy vékony aranyfóliás céltárgyra irányított α-részecskeáram eltérítésének kimutatására használt. A részecskéket egy rádiummintából állították elő. (b) Ha Thomson atommodellje helyes lenne, az α-részecskéknek egyenesen át kellett volna haladniuk az aranyfólián. (c) Azonban egy kis számú α-részecske különböző irányokba terelődött el, többek között egyenesen vissza a forráshoz. Ez csak akkor lehetett igaz, ha a pozitív töltés sokkal nagyobb tömegű volt, mint az α-részecske. Azt sugallta, hogy az aranyatom tömege egy nagyon kis térrészben koncentrálódik, amelyet ő magnak nevezett. A képet engedéllyel használták (CC BY-SA-NC).
Rutherford eredményei nem voltak összhangban egy olyan modellel, amelyben a tömeg és a pozitív töltés egyenletesen oszlik el az atom térfogatában. Ehelyett határozottan azt sugallták, hogy mind a tömeg, mind a pozitív töltés az atom térfogatának egy apró töredékében koncentrálódik, amelyet Rutherford atommagnak nevezett. Értelemszerűen az α-részecskék egy kis töredéke ütközött a sűrű, pozitív töltésű atommagokkal, vagy úgy, hogy a részecskék villanásszerűen ütköztek, ami nagy eltéréseket eredményezett, vagy szinte frontálisan, ami egyenesen visszaverődött a forráshoz.
Noha Rutherford nem tudta megmagyarázni, hogy az egynél több pozitív töltést tartalmazó atommagokban a pozitív töltések közötti taszítások miért nem okozzák az atommag szétesését, arra következtetett, hogy a negatív töltésű elektronok közötti taszítások miatt az elektronok egyenletesen oszlanak el az atom térfogatában. ma már tudjuk, hogy a protonokat és a neutronokat az atommagban az elektrosztatikus kölcsönhatásoknál sokkal erősebb erős magerők tartják össze. Ezért és más meglátásaiért Rutherford 1908-ban kémiai Nobel-díjat kapott. Sajnos Rutherford inkább a fizikai Nobel-díjat szerette volna megkapni, mert a fizikát a kémiánál magasabb rendűnek tartotta. Szerinte “Minden tudomány vagy fizika, vagy bélyeggyűjtés.”
 2.4.8
2.4.8
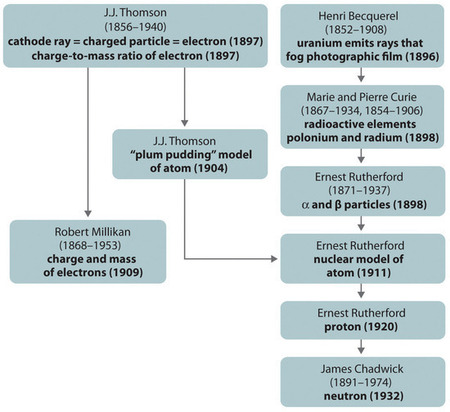
Ábra \(\PageIndex{11}\): Az atom alkotóelemeire és szerkezetére vonatkozó modellek történeti fejlődésének összefoglalása. A zárójelben lévő dátumok azok az évek, amikor a legfontosabb kísérleteket elvégezték. A kép felhasználása engedéllyel történt (CC BY-SA-NC).
Az atom szerkezetére vonatkozó különböző modellek történelmi fejlődését a (\(\PageIndex{11}\) ábra) foglalja össze. Rutherford megállapította, hogy a hidrogénatom magja egy pozitív töltésű részecske, amelyre 1920-ban a proton nevet adta. Azt is felvetette, hogy a hidrogéntől eltérő elemek magjainak elektromosan semleges részecskéket kell tartalmazniuk, amelyek tömege megközelítőleg megegyezik a protonéval. A neutront azonban csak 1932-ben fedezték fel, amikor James Chadwick (1891-1974, Rutherford tanítványa; fizikai Nobel-díj, 1935) felfedezte. Rutherford munkájának eredményeként vált világossá, hogy az α részecske két protont és egy neutront tartalmaz, és ezért a héliumatom magja.
2.4.9
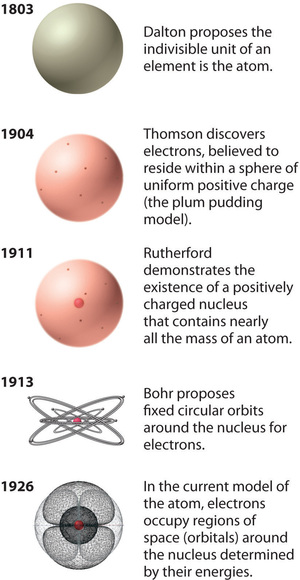
Ábra \(\PageIndex{12}\): Az atomelmélet fejlődése az oxigénatom modelljeivel szemléltetve. Bohr modelljét és a jelenlegi modellt a 6. fejezetben, “Az atomok szerkezete” című fejezetben ismertetjük. A képet engedéllyel használjuk (CC BY-SA-NC).
Rutherford atommodellje lényegében megegyezik a mai modellel, azzal a különbséggel, hogy ma már tudjuk, hogy az elektronok nem egyenletesen oszlanak el az atom térfogatában. Ehelyett a kvantummechanika által leírt elvek szerint oszlanak el. A \(\PageIndex{12}\) ábra azt mutatja, hogyan fejlődött az atom modellje az idők során a daltoni oszthatatlan egységtől a ma tanított modern felfogásig.