Cíle učení
- Vysvětlete, proč jsou teploty varu alkoholů vyšší než teploty varu etherů a alkanů s podobnou molární hmotností.
- Vysvětlete, proč jsou alkoholy a ethery se čtyřmi nebo méně atomy uhlíku rozpustné ve vodě, zatímco srovnatelné alkany rozpustné nejsou.
Alkoholy lze považovat za deriváty vody (H2O; píše se také jako HOH).

Stejně jako vazba H-O-H ve vodě je vazba R-O-H ohnutá a molekuly alkoholu jsou polární. Tato vazba je patrná zejména u malých molekul a odráží se ve fyzikálních a chemických vlastnostech alkoholů s nízkou molární hmotností. Nahrazení atomu vodíku z alkanu skupinou OH umožňuje molekulám spojit se prostřednictvím vodíkové vazby (obrázek \(\PageIndex{1}\)).
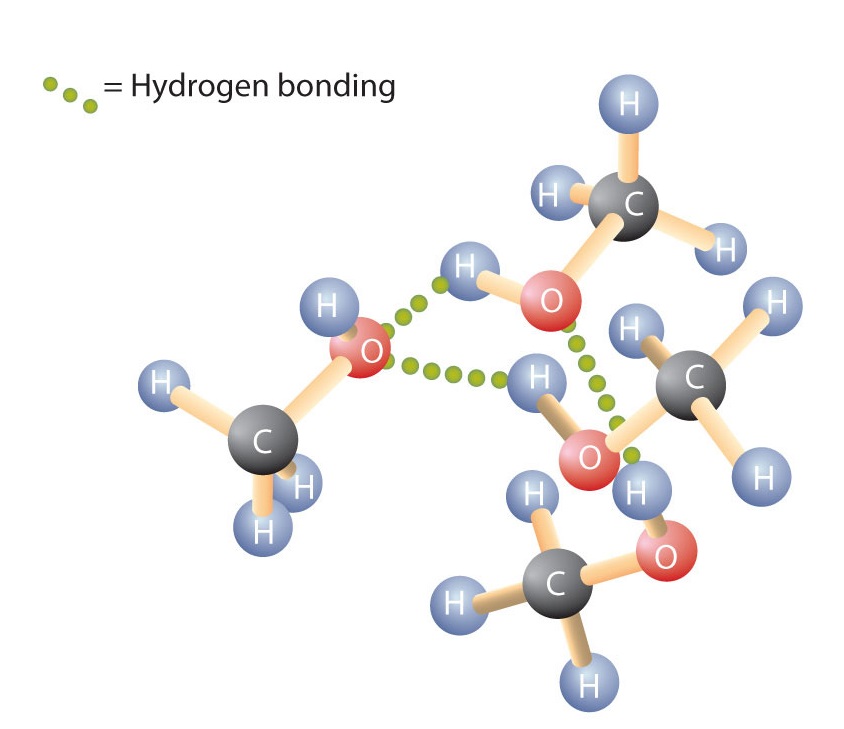
Připomeňte si, že fyzikální vlastnosti jsou do značné míry určeny typem mezimolekulárních sil. V tabulce \(\PageIndex{1}\) jsou uvedeny molární hmotnosti a teploty varu některých běžných sloučenin. Tabulka ukazuje, že látky s podobnými molárními hmotnostmi mohou mít zcela odlišné teploty varu.
| Formula | Název | Molární hmotnost | Teplota varu (°C) |
|---|---|---|---|
| CH4 | methan | 16 | -164 |
| HOH | voda | 18 | 100 |
| C2H6 | ethane | 30 | -89 |
| CH3OH | metanol | 32 | 65 |
| C3H8 | propan | 44 | -42 |
| CH3CH2OH | etanol | 46 | 78 |
| C4H10 | butan | 58 | -1 |
| CH3CH2CH2OH | 1-propanol | 60 | 97 |
Alkany jsou nepolární, a proto jsou spojeny pouze prostřednictvím relativně slabých disperzních sil. Alkany s jedním až čtyřmi atomy uhlíku jsou při pokojové teplotě plyny. Naproti tomu i metanol (s jedním atomem uhlíku) je při pokojové teplotě kapalina. Vodíková vazba výrazně zvyšuje teplotu varu alkoholů ve srovnání s uhlovodíky o srovnatelné molární hmotnosti. Bod varu je hrubým měřítkem množství energie potřebné k oddělení molekuly kapaliny od jejích nejbližších sousedů. Pokud na sebe molekuly vzájemně působí prostřednictvím vodíkové vazby, je třeba dodat poměrně velké množství energie, aby se tyto mezimolekulární přitažlivosti přerušily. Teprve pak může molekula přejít z kapalného do plynného stavu.
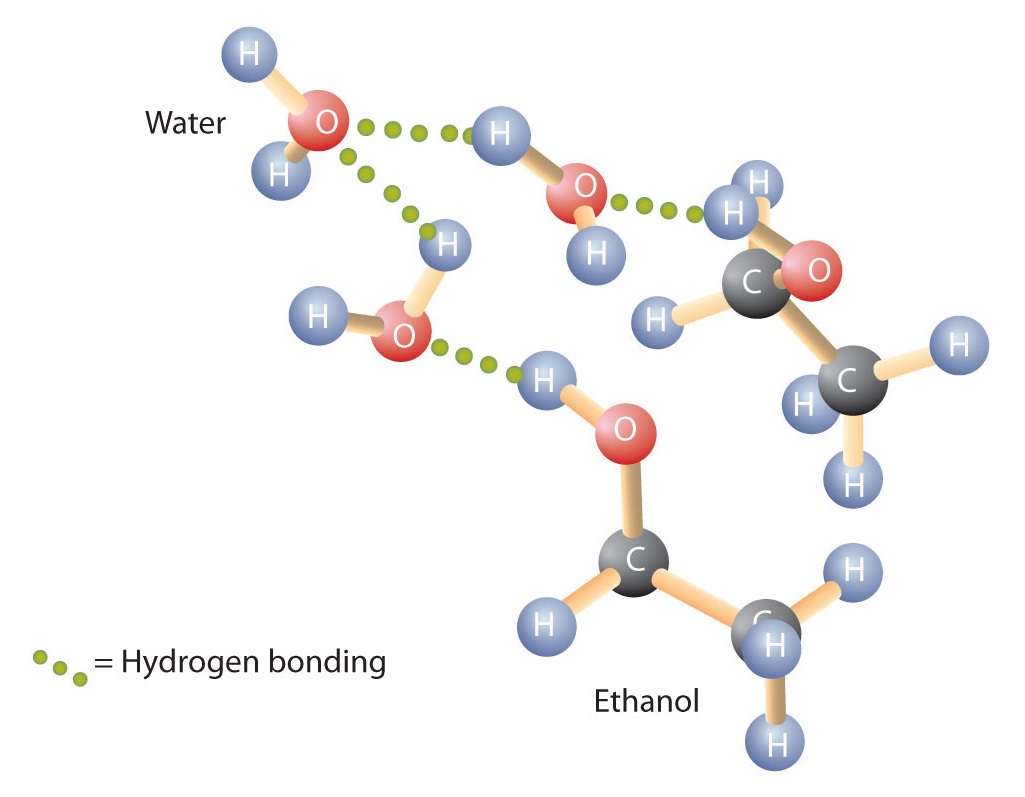
Alkoholy se také mohou zapojit do vodíkové vazby s molekulami vody (obrázek \(\PageIndex{2}\)). Zatímco tedy uhlovodíky jsou ve vodě nerozpustné, alkoholy s jedním až třemi atomy uhlíku jsou zcela rozpustné. S rostoucí délkou řetězce však rozpustnost alkoholů ve vodě klesá; molekuly se více podobají uhlovodíkům a méně vodě. Alkohol 1-dekanol (CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2OH) je ve vodě v podstatě nerozpustný. Často se setkáváme s tím, že hranice rozpustnosti v rodině organických sloučenin nastává při čtyřech nebo pěti atomech uhlíku.
Shrnutí
Alkoholy mají vyšší teploty varu než ethery a alkany o podobné molární hmotnosti, protože OH skupina umožňuje molekulám alkoholu zapojit se do vodíkové vazby. Alkoholy se čtyřmi nebo méně atomy uhlíku jsou rozpustné ve vodě, protože molekuly alkoholu se zapojují do vodíkové vazby s molekulami vody; srovnatelné molekuly alkanů se do vodíkové vazby zapojit nemohou.
Cvičení na přehled pojmů
-
Proč je etanol ve vodě rozpustnější než 1-hexanol
-
Proč má 1-butanol nižší bod varu než 1-hexanol?
Odpovědi
-
Ethanol má OH skupinu a pouze 2 atomy uhlíku; 1-hexanol má jednu OH skupinu na 6 atomů uhlíku, a je tedy podobnější (nepolárnímu) uhlovodíku než etanol.
-
Molární hmotnost 1-hexanolu je větší než molární hmotnost 1-butanolu.
Cvičení
Odpovězte následující cvičení bez nahlížení do tabulek v textu:
-
Uspořádejte tyto alkoholy v pořadí podle rostoucí teploty varu: ethanol, methanol a 1-propanol.
-
Který z těchto alkoholů má vyšší bod varu – butan nebo 1-propanol?
-
Seřaďte tyto alkoholy v pořadí podle rostoucí rozpustnosti ve vodě: 1-butanol, metanol a 1-oktanol.
-
Uspořádejte tyto sloučeniny v pořadí podle rostoucí rozpustnosti ve vodě: 1-butanol, etanol a pentan.
Odpovědi
-
metanol < etanol < 1-propanol
-
1-oktanol < 1-butanol < metanol