Cíle učení
- Znát vztah mezi silou kyseliny nebo zásady a velikostí \(K_a\), \(K_b\), \(pK_a\) a \(pK_b\).
- Pochopit vyrovnávací efekt.
Velikost rovnovážné konstanty pro ionizační reakci lze použít k určení relativní síly kyselin a zásad. Například obecná rovnice pro ionizaci slabé kyseliny ve vodě, kde HA je mateřská kyselina a A- je její konjugovaná zásada, je následující:
\
Rovnovážná konstanta pro tuto disociaci je následující:
\}{}. \label{16.5.2}}]
Jak jsme již dříve poznamenali, koncentrace vody je v podstatě konstantní pro všechny reakce ve vodném roztoku, takže \(\) v rovnici \(\ref{16.5.2}}) lze začlenit do nové veličiny, ionizační konstanty kyseliny (\(K_a\)), nazývané také disociační konstanta kyseliny:
\=\dfrac{}{} \label{16.5.3}\]
Tak se číselné hodnoty K a \(K_a\) liší podle koncentrace vody (55,3 M). Pro zjednodušení lze \(H_3O^+\) opět zapsat jako \(H^+\) v rovnici \(\ref{16.5.3}\). Mějte však na paměti, že volné \(H^+\) ve vodných roztocích neexistuje a že při všech ionizačních reakcích kyselin se proton přenáší na \(H_2O\) za vzniku hydroniových iontů, \(H_3O^+\). Čím větší je \(K_a\), tím silnější je kyselina a tím vyšší je koncentrace \(H^+\) v rovnovážném stavu. Stejně jako všechny rovnovážné konstanty se i acidobazické ionizační konstanty ve skutečnosti měří jako aktivity \(H^+\) nebo \(OH^-\), takže jsou bez jednotek. Hodnoty \(K_a\) pro řadu běžných kyselin jsou uvedeny v tabulce \(\PageIndex{1}\).
Slabé zásady reagují s vodou za vzniku hydroxidového iontu, jak ukazuje následující obecná rovnice, kde B je výchozí zásada a BH+ je její konjugovaná kyselina:
\
Rovnovážná konstanta pro tuto reakci je ionizační konstanta zásady (Kb), nazývaná také disociační konstanta zásady:
\= \frac{}{} \label{16.5.5}\]
Koncentrace vody je opět konstantní, takže se ve výrazu pro rovnovážnou konstantu neobjevuje; místo toho je zahrnuta ve vzorci \(K_b\). Čím větší je \(K_b\), tím silnější je báze a tím vyšší je koncentrace \(OH^-\) v rovnovážném stavu. Hodnoty \(K_b\) pro řadu běžných slabých zásad jsou uvedeny v tabulce \(\PageIndex{2}\).
Existuje jednoduchý vztah mezi velikostí \(K_a\) pro kyselinu a \(K_b\) pro její konjugovanou zásadu. Uvažujme například ionizaci kyseliny kyanovodíkové (\(HCN\)) ve vodě za vzniku kyselého roztoku a reakci \(CN^-\) s vodou za vzniku zásaditého roztoku:
\
\
Vyjádření rovnovážné konstanty pro ionizaci HCN je následující:
\}{} \label{16.5.8}\]
Odpovídající výraz pro reakci kyanidu s vodou je následující:
\}{} \label{16.5.9}\]
Složíme-li rovnice \(\ref{16.5.6}\) a \(\ref{16.5.7}\), získáme následující:
| Reakční | Rovnovážné konstanty |
|---|---|
| \(\cancel{HCN_{(aq)}}) \rightleftharpoons H^+_{(aq)}+\cancel{CN^-_{(aq)}} \) | \(K_a=\cancel{}/\cancel{}\) |
| \(\cancel{CN^-_{(aq)}}+H_2O_{(l)} \rightleftharpoons OH^-_{(aq)}+\cancel{HCN_{(aq)}}}\) | \(K_b=\cancel{}/\cancel{}\) |
| \(H_2O_{(l)} \rightleftharpoons H^+_{(aq)}+OH^-_{(aq)}\) | \(K=K_a \times K_b=\) |
V tomto případě, je součet reakcí popsaných \(K_a\) a \(K_b\) rovnicí pro autoionizaci vody a součin obou rovnovážných konstant je \(K_w\):
\
Známe-li tedy buď \(K_a\) pro kyselinu, nebo \(K_b\) pro její konjugovanou zásadu, můžeme vypočítat druhou rovnovážnou konstantu pro libovolný konjugovaný pár kyseliny a zásady.
Stejně jako u \(pH\), \(pOH\) a pKw můžeme použít záporné logaritmy, abychom se vyhnuli exponenciálnímu zápisu při zápisu ionizačních konstant kyselin a zásad, a to definováním \(pK_a\) takto:
\
\
a \(pK_b\) jako
\
\
Podobně rovnice \(\ref{16.5.10}\), která vyjadřuje vztah mezi \(K_a\) a \(K_b\), lze zapsat v logaritmickém tvaru takto:
\
Při 25 °C to znamená
\
Hodnoty \(pK_a\) a \(pK_b\) jsou uvedeny pro několik běžných kyselin a zásad v tabulkách \(\PageIndex{1}\) a \(\PageIndex{2}\), a rozsáhlejší soubor údajů je uveden v tabulkách E1 a E2. Vzhledem k použití záporných logaritmů odpovídají menší hodnoty \(pK_a\) větším ionizačním konstantám kyselin, a tedy silnějším kyselinám. Například kyselina dusičná (\(HNO_2\)), jejíž \(pK_a\) je 3,25, je asi milionkrát silnější kyselinou než kyselina kyanovodíková (HCN), jejíž \(pK_a\) je 9,21. Naopak menší hodnoty \(pK_b\) odpovídají větším ionizačním konstantám zásad, a tedy silnějším zásadám.
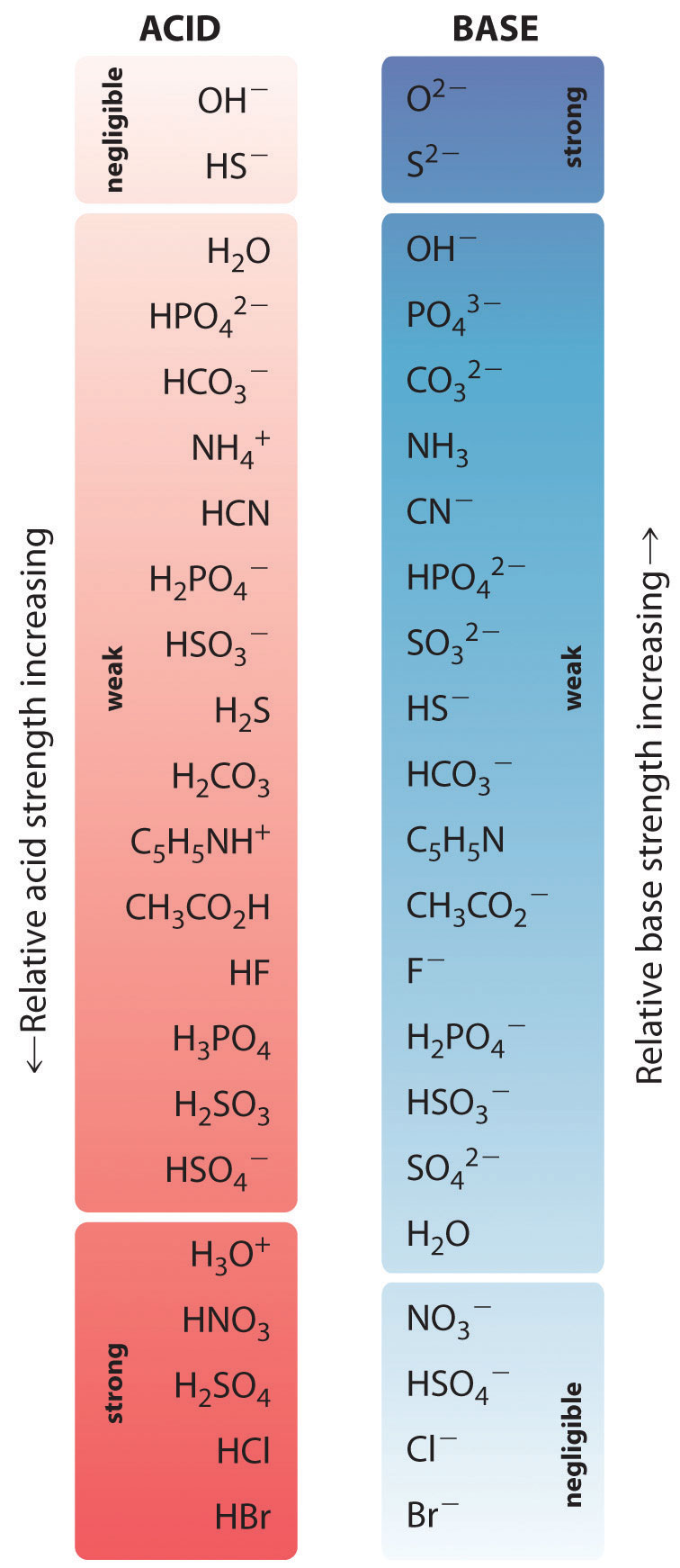
Relativní síly některých běžných kyselin a jejich konjugovaných bází jsou graficky znázorněny na obrázku \(\PageIndex{1}\). Dvojice konjugovaných kyselin a zásad jsou uvedeny v pořadí (shora dolů) podle rostoucí síly kyseliny, což odpovídá klesajícím hodnotám \(pK_a\). Toto pořadí odpovídá klesající síle konjugované báze nebo rostoucím hodnotám \(pK_b\). Vlevo dole na obrázku \(\PageIndex{2}\) jsou běžné silné kyseliny; vpravo nahoře jsou nejběžnější silné zásady. Všimněte si inverzního vztahu mezi silou mateřské kyseliny a silou konjugované báze. Konjugovaná báze silné kyseliny je tedy velmi slabá báze a konjugovaná báze velmi slabé kyseliny je silná báze.
Konjugovaná báze silné kyseliny je slabá báze a naopak.
K předpovědi směru acidobazické reakce můžeme použít relativní síly kyselin a zásad podle jediného pravidla: acidobazická rovnováha vždy zvýhodňuje stranu se slabší kyselinou a zásadou, jak naznačují tyto šipky:
\
V acidobazické reakci reaguje proton vždy se silnější zásadou.
Například kyselina chlorovodíková je silná kyselina, která ve zředěném vodném roztoku v podstatě zcela ionizuje za vzniku \(H_3O^+\) a \(Cl^-\); pouze zanedbatelné množství molekul \(HCl\) zůstává nedisociováno. Proto leží ionizační rovnováha prakticky celá vpravo, jak je znázorněno jedinou šipkou:
\
Kyselina octová je naopak slabá kyselina a voda je slabá zásada. Proto vodné roztoky kyseliny octové obsahují převážně molekuly kyseliny octové v rovnováze s malou koncentrací \(H_3O^+\) a octanových iontů a ionizační rovnováha leží daleko vlevo, jak je znázorněno těmito šipkami:
\
Podobně při reakci amoniaku s vodou je hydroxidový ion silnou zásadou a amoniak je slabou zásadou, zatímco amonný ion je silnější kyselinou než voda. Proto i tato rovnováha leží vlevo:
\
Všechny acidobazické rovnováhy jsou ve prospěch strany se slabší kyselinou a zásadou. Proton je tedy vázán na silnější zásadu.
Příklad \(\PageIndex{1}\): Vypočítejte \(K_b\) a \(pK_b\) butyrátového iontu (\(CH_3CH_2CH_2CO_2^-\). \(pK_a\) kyseliny máselné při 25 °C je 4,83. Kyselina máselná je zodpovědná za nepříjemný zápach žluklého másla.
Dáno: \(pK_a\) a \(K_b\)
Zadáno: odpovídající \(K_b\) a \(pK_b\), \(K_a\) a \(pK_a\)
Strategie:
Konstanty \(K_a\) a \(K_b\) souvisejí podle rovnice \(\ref{16.5.10}\). Konstanty \(pK_a\) a \(pK_b\) pro kyselinu a její konjugovanou zásadu souvisejí podle rovnic \(\ref{16.5.15}\) a \(\ref{16.5.16}\). K převodu mezi \(K_a\) a \(pK_a\) nebo \(K_b\) a \(pK_b\) použijte vztahy pK = -log K a K = 10-pK (rovnice \(\ref{16.5.11}\) a \(\ref{16.5.13}\).
Řešení:
Máme k dispozici \(pK_a\) pro kyselinu máselnou a máme vypočítat \(K_b\) a \(pK_b\) pro její konjugovanou bázi, butyrátový ion. Protože uvedená hodnota \(pK_a\) platí pro teplotu 25 °C, můžeme použít rovnici \(\ref{16.5.16}\): \(pK_a\) + \(pK_b\) = pKw = 14,00. Dosazením \(pK_a\) a řešením pro \(pK_b\),
\
\
Protože \(pK_b = -\log K_b\), \(K_b\) je \(10^{-9,17} = 6,8 \krát 10^{-10}\).
V tomto případě je dáno \(K_b\) pro zásadu (dimetylamin) a máme vypočítat \(K_a\) a \(pK_a\) pro její konjugovanou kyselinu, dimetylamonný ion. Protože výchozí zadaná veličina je \(K_b\) a nikoli \(pK_b\), můžeme použít rovnici \(\ref{16.5.10}\): \(K_aK_b = K_w\). Dosazením hodnot \(K_b\) a \(K_w\) při 25 °C a řešením pro \(K_a\),
\
\
Protože \(pK_a\) = -log \(K_a\), máme \(pK_a = -\log(1,9 \krát 10^{-11}) = 10,72\). Mohli bychom také převést \(K_b\) na \(pK_b\) a získat stejnou odpověď:
\
\
\
\
Pokud je dána jedna z těchto čtyř veličin pro kyselinu nebo zásadu (\(K_a\), \(pK_a\), \(K_b\) nebo \(pK_b\)), můžeme vypočítat ostatní tři.
Cvičení \(\PageIndex{1}\): Kyselina mléčná
Kyselina mléčná (\(CH_3CH(OH)CO_2H\)) je zodpovědná za štiplavou chuť a vůni kyselého mléka; předpokládá se, že také způsobuje bolestivost unavených svalů. Její \(pK_a\) je 3,86 při 25 °C. Vypočítejte \(K_a\) pro kyselinu mléčnou a \(pK_b\) a \(K_b\) pro laktátový ion.
Odpověď
- \(K_a = 1,4 \krát 10^{-4}\) pro kyselinu mléčnou;
- \(pK_b\) = 10.14 a
- \(K_b = 7,2 \krát 10^{-11}\) pro mléčný ion
- Roztoky silných kyselin a zásad: V tabulce \(\PageIndex{1}\) si všimnete, že kyseliny jako \(H_2SO_4\) a \(HNO_3\) leží nad hydroniovým iontem, což znamená, že mají hodnoty \(pK_a\) menší než nula a jsou silnějšími kyselinami než iont \(H_3O^+\). Připomeňme si z kapitoly 4, že kyselý proton je prakticky ve všech oxokyselinách vázán na jeden z atomů kyslíku oxoaniontu. Proto by se kyselina dusičná měla správně zapisovat jako \(HONO_2\). Bohužel se však vzorce oxokyselin téměř vždy zapisují s vodíkem vlevo a kyslíkem vpravo, takže místo toho vzniká \(HNO_3\). Ve skutečnosti má všech šest běžných silných kyselin, s nimiž jsme se poprvé setkali v kapitole 4, hodnoty \(pK_a\) menší než nula, což znamená, že mají větší tendenci ztrácet proton než ion \(H_3O^+\). Naopak konjugované zásady těchto silných kyselin jsou slabšími zásadami než voda. V důsledku toho leží rovnováhy přenosu protonu pro tyto silné kyseliny daleko vpravo a přidání kterékoli z běžných silných kyselin do vody vede v podstatě ke stechiometrické reakci kyseliny s vodou za vzniku roztoku iontu \(H_3O^+\) a konjugované báze kyseliny.
- Polyprotické kyseliny a zásady
- Souhrn
- Klíčové rovnice
- Přispěvatelé a atributy
Roztoky silných kyselin a zásad: V tabulce \(\PageIndex{1}\) si všimnete, že kyseliny jako \(H_2SO_4\) a \(HNO_3\) leží nad hydroniovým iontem, což znamená, že mají hodnoty \(pK_a\) menší než nula a jsou silnějšími kyselinami než iont \(H_3O^+\). Připomeňme si z kapitoly 4, že kyselý proton je prakticky ve všech oxokyselinách vázán na jeden z atomů kyslíku oxoaniontu. Proto by se kyselina dusičná měla správně zapisovat jako \(HONO_2\). Bohužel se však vzorce oxokyselin téměř vždy zapisují s vodíkem vlevo a kyslíkem vpravo, takže místo toho vzniká \(HNO_3\). Ve skutečnosti má všech šest běžných silných kyselin, s nimiž jsme se poprvé setkali v kapitole 4, hodnoty \(pK_a\) menší než nula, což znamená, že mají větší tendenci ztrácet proton než ion \(H_3O^+\). Naopak konjugované zásady těchto silných kyselin jsou slabšími zásadami než voda. V důsledku toho leží rovnováhy přenosu protonu pro tyto silné kyseliny daleko vpravo a přidání kterékoli z běžných silných kyselin do vody vede v podstatě ke stechiometrické reakci kyseliny s vodou za vzniku roztoku iontu \(H_3O^+\) a konjugované báze kyseliny.
Ačkoli je \(K_a\) pro \(HI\) asi o 108 větší než \(K_a\) pro \(HNO_3\), reakce \(HI\) nebo \(HNO_3\) s vodou dává v podstatě stechiometrický roztok \(H_3O^+\) a I- nebo \(NO_3^-\). Ve skutečnosti 0,1 M vodný roztok jakékoli silné kyseliny obsahuje 0,1 M \(H_3O^+\) bez ohledu na identitu silné kyseliny. Tento jev se nazývá vyrovnávací efekt: každý druh, který je silnější kyselinou než konjugovaná kyselina vody (\(H_3O^+\)), je ve vodném roztoku vyrovnán na sílu \(H_3O^+\), protože \(H_3O^+\) je nejsilnější kyselinou, která může existovat v rovnováze s vodou. V důsledku toho není možné rozlišit sílu kyselin, jako je HI a HNO3, ve vodném roztoku a ke stanovení jejich relativní síly je třeba použít alternativní přístup.
Jednou z metod je použití rozpouštědla, jako je bezvodá kyselina octová. Protože kyselina octová je silnější kyselinou než voda, musí být také slabší zásadou s menší tendencí přijímat proton než \(H_2O\). Měření vodivosti 0,1 M roztoků HI i \(HNO_3\) v kyselině octové ukazuje, že HI je zcela disociován, ale \(HNO_3\) je disociován pouze částečně a v tomto rozpouštědle se chová jako slabá kyselina. Tento výsledek jasně říká, že HI je silnější kyselina než \(HNO_3\). Relativní pořadí síly kyselin a přibližné hodnoty \(K_a\) a \(pK_a\) pro silné kyseliny v horní části tabulky \(\PageIndex{1}\) byly stanoveny pomocí těchto měření a různých nevodných rozpouštědel.
Ve vodných roztocích je \(H_3O^+\) nejsilnější kyselinou a \(OH^-\) nejsilnější zásadou, která může existovat v rovnováze s \(H_2O\).
Vyrovnávací efekt platí i pro roztoky silných zásad: Ve vodném roztoku je každá báze silnější než OH- vyrovnána na sílu OH-, protože OH- je nejsilnější báze, která může existovat v rovnováze s vodou. Soli jako \(K_2O\), \(NaOCH_3\) (methoxid sodný) a \(NaNH_2\) (sodamid nebo amid sodný), jejichž anionty jsou konjugovanými bázemi druhů, které by v tabulce \(\PageIndex{2}\) ležely pod vodou, jsou všechny silné báze, které v podstatě úplně (a často prudce) reagují s vodou, přijímají proton za vzniku roztoku \(OH^-\) a příslušného kationtu:
\
\
\
Dalšími příklady, se kterými se můžete setkat, jsou hydrid draselný (\(KH\)) a organokovové sloučeniny, jako je methyl lithium (\(CH_3Li\)).
Polyprotické kyseliny a zásady
Jak jste se naučili, polyprotické kyseliny jako \(H_2SO_4\), \(H_3PO_4\) a \(H_2CO_3\) obsahují více než jeden ionizovatelný proton a protony se ztrácejí postupně. Plně protonovaný druh je vždy nejsilnější kyselinou, protože je snazší odebrat proton z neutrální molekuly než ze záporně nabitého iontu. Síla kyseliny tedy klesá se ztrátou dalších protonů a v souladu s tím se zvyšuje \(pK_a\). Uvažujme například \(H_2SO_4\):
\
Rovnováha v první reakci leží daleko vpravo, což odpovídá tomu, že \(H_2SO_4\) je silná kyselina. Naproti tomu ve druhé reakci jsou v rovnováze přítomna znatelná množství jak \(HSO_4^-\), tak \(SO_4^{2-}\).
Pro polyprotovou kyselinu se síla kyseliny snižuje a \(pK_a\) se zvyšuje s postupnou ztrátou každého protonu.
Síranovodíkový iont (\(HSO_4^-\)) je konjugovanou zásadou \(H_2SO_4\) i konjugovanou kyselinou \(SO_4^{2-}\). Stejně jako voda se tedy HSO4- může chovat jako kyselina nebo zásada v závislosti na tom, zda je druhý reaktant silnější kyselinou nebo silnější zásadou. Naopak síranový iont (\(SO_4^{2-}\)) je polyprotonní báze, která je schopna přijímat dva protony postupným způsobem:
\
\
Stejně jako u jakékoli jiné konjugované dvojice kyseliny a zásady platí pro síly konjugovaných kyselin a zásad vztah \(pK_a\) + \(pK_b\) = pKw. Uvažujme například dvojici \(HSO_4^-/ SO_4^{2-}\) konjugované kyseliny a zásady. Z tabulky \(\PageIndex{1}\) vidíme, že \(pK_a\) \(HSO_4^-\) je 1,99. Proto je \(pK_b\) \(SO_4^{2-}\) 14,00 – 1,99 = 12,01. Síran je tedy spíše slabá báze, zatímco \(OH^-\) je silná báze, takže rovnováha uvedená v rovnici \(\ref{16,6}\) leží vlevo. Iont \(HSO_4^-\) je také velmi slabá báze (\(pK_a\) \(H_2SO_4\) = 2,0, \(pK_b\) \(HSO_4^- = 14 – (-2,0) = 16\)), což odpovídá tomu, co očekáváme u konjugované báze silné kyseliny.
Příklad \(\PageIndex{2}\)
Předpovězte, zda rovnováha pro každou reakci leží vlevo nebo vpravo, jak je napsáno.
- \(NH^+_{4(aq)}+PO^{3-}_{4(aq)}. \rightleftharpoons NH_{3(aq)}+HPO^{2−}_{4(aq)}\)
- \(CH_3CH_2CO_2H_{(aq)}+CN^−_{(aq)} \rightleftharpoons CH_3CH_2CO^-_{2(aq)}+HCN_{(aq)}\)
Dáno: vyvážená chemická rovnice
Zadáno: rovnovážná poloha
Strategie:
Určete konjugované páry kyselina-látka v každé reakci. Potom se podívejte do tabulek \(\PageIndex{1}\)a\(\PageIndex{2}\) a na obrázek \(\PageIndex{2}\) a určete, která kyselina a zásada je silnější. Rovnováha vždy upřednostňuje vznik slabšího páru kyseliny a zásady.
Roztok:
Konjugované páry kyseliny a zásady jsou \(NH_4^+/NH_3\) a \(HPO_4^{2-}/PO_4^{3-}\). Podle tabulek \(\PageIndex{1}\) a \(\PageIndex{2}\) je \(NH_4^+\) silnější kyselinou (\(pK_a = 9.25\) než \(HPO_4^{2-}\) (pKa = 12,32) a \(PO_4^{3-}\) je silnější zásada (\(pK_b = 1,68\)) než \(NH_3\) (\(pK_b = 4,75\)). Rovnováha tedy bude ležet vpravo a bude upřednostňovat vznik slabšího páru kyseliny a zásady:
\
Konjugované páry kyseliny a zásady jsou \(CH_3CH_2CO_2H/CH_3CH_2CO_2^-\) a \(HCN/CN^-\). Podle tabulky \(\PageIndex{1}\) je HCN slabá kyselina (pKa = 9,21) a \(CN^-\) středně slabá zásada (pKb = 4,79). Kyselina propionová (\(CH_3CH_2CO_2H\)) však v tabulce \(\PageIndex{1}\) uvedena není. V takové situaci je nejlepší vyhledat podobnou sloučeninu, jejíž acidobazické vlastnosti jsou uvedeny. Například kyselina propionová a kyselina octová jsou identické s výjimkou skupin připojených k atomu uhlíku karboxylové kyseliny (\(\ce{-CH_2CH_3}\) versus \(\ce{-CH_3}\)), takže můžeme očekávat, že tyto dvě sloučeniny budou mít podobné acidobazické vlastnosti. Zejména bychom očekávali, že \(pK_a\) kyseliny propionové bude mít podobnou velikost jako \(pK_a\) kyseliny octové. (Ve skutečnosti je \(pK_a\) kyseliny propionové 4,87 oproti 4,76 pro kyselinu octovou, což činí kyselinu propionovou o něco slabší kyselinou než kyselinu octovou.) Kyselina propionová by tedy měla být výrazně silnější kyselinou než \(HCN\). Protože silnější kyselina tvoří slabší konjugovanou bázi, předpokládáme, že kyanid bude silnější bází než propionát. Rovnováha tedy bude ležet vpravo a bude upřednostňovat vznik slabšího páru kyseliny a zásady:
\
Cvičení \(\PageIndex{1}\)
Předpovězte, zda rovnováha pro každou reakci leží vlevo nebo vpravo, jak je napsáno.
- \(H_2O_{(l)}+HS^-_{(aq)} \rightleftharpoons OH^−_{(aq)}+H_2S_{(aq)}\)
- \(HCO^−_{2(aq)}+HSO^−_{4(aq)} \rightleftharpoons HCO_2H_{(aq)}+SO^{2-}_{4(aq)}\)
Odpověď a
levá
Odpověď b
levá
Souhrn
Acidobazické reakce obsahují vždy dva konjugované páry kyseliny a zásady. Každá kyselina a každá zásada má přiřazenou ionizační konstantu, která odpovídá síle její kyseliny nebo zásady. Dva druhy, které se liší pouze o jeden proton, tvoří konjugovaný acidobazický pár. Velikost rovnovážné konstanty pro ionizační reakci lze použít k určení relativní síly kyselin a zásad. Pro vodný roztok slabé kyseliny se disociační konstanta nazývá ionizační konstanta kyseliny (\(K_a\)). Podobně se rovnovážná konstanta pro reakci slabé zásady s vodou nazývá ionizační konstanta zásady (\(K_b\)). Pro jakoukoli konjugovanou dvojici kyseliny a zásady platí \(K_aK_b = K_w\). Menší hodnoty \(pK_a\) odpovídají větším ionizačním konstantám kyselin, a tedy silnějším kyselinám. Naopak menší hodnoty \(pK_b\) odpovídají větším ionizačním konstantám zásad, a tedy silnějším zásadám. Při 25 °C je \(pK_a + pK_b = 14,00\). Acidobazické reakce probíhají vždy ve směru, který vytváří slabší pár kyseliny a zásady. Ve vodném roztoku nemůže existovat žádná kyselina silnější než \(H_3O^+\) a žádná zásada silnější než \(OH^-\), což vede k jevu známému jako vyrovnávací efekt. Polyprotické kyseliny (a zásady) ztrácejí (a získávají) protony postupně, přičemž plně protonovaný druh je nejsilnější kyselinou a plně deprotonovaný druh je nejsilnější zásadou.
Klíčové rovnice
- Ionizační konstanta kyseliny: \=\dfrac{}{} \]
- Základní ionizační konstanta: \= \dfrac{}{} \]
- Vztah mezi \(K_a\) a \(K_b\) konjugovaného páru kyseliny a zásady: \
- Definice \(pK_a\): \
- Definice \(pK_b\): \ Vztah mezi \(pK_a\) a \(pK_b\) konjugovaného páru kyseliny a zásady: \ \
Přispěvatelé a atributy
-
Stephen Lower, emeritní profesor (Simon Fraser U.) Virtuální učebnice Chem1