Entropie
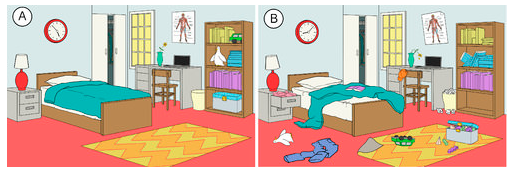
V přírodě existuje tendence systémů směřovat ke stavu většího nepořádku nebo náhodnosti. Entropie je mírou míry nahodilosti nebo neuspořádanosti systému. Entropii je snadné pochopit při přemýšlení o každodenních situacích. Entropie místnosti, která byla nedávno uklizena a uspořádána, je nízká. Postupem času se pravděpodobně stane více neuspořádanou, a tím se její entropie zvýší (viz obrázek níže). Přirozenou tendencí systému je zvyšování jeho entropie.
Chemické reakce mají také tendenci probíhat tak, že zvyšují celkovou entropii systému. Jak zjistíte, zda určitá reakce vykazuje zvýšení nebo snížení entropie? Určité vodítko poskytuje molekulární stav reaktantů a produktů. Níže uvedené obecné případy ilustrují entropii na molekulární úrovni.
- Pro danou látku je entropie kapalného stavu větší než entropie pevného stavu. Stejně tak entropie plynu je větší než entropie kapaliny. Proto se entropie zvyšuje při procesech, při nichž pevné nebo kapalné reaktanty tvoří plynné produkty. Entropie se také zvyšuje, když pevné reaktanty tvoří kapalné produkty.
- Entropie se zvyšuje, když se látka rozkládá na více částí. Proces rozpouštění zvyšuje entropii, protože při vzniku roztoku se částice rozpuštěné látky od sebe oddělují.
- Entropie se zvyšuje s rostoucí teplotou. Zvýšení teploty znamená, že částice látky mají větší kinetickou energii. Rychleji se pohybující částice mají větší neuspořádanost než částice, které se při nižší teplotě pohybují pomaleji.
- Entropie obecně roste při reakcích, při nichž je celkový počet molekul produktu větší než celkový počet molekul reaktantu. Výjimkou z tohoto pravidla je případ, kdy se z nevodných reaktantů vyrábí plyn.
Následující příklady poslouží k ilustraci, jak lze předpovědět změnu entropie v reakci.
\(\ce{Cl_2}) \left( g \right) \rightarrow \ce{Cl_2} \left( l \right)\)
Entropie klesá, protože plyn se mění v kapalinu.
\(\ce{CaCO_3} \levice( s \pravice) \pravá šipka \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right)\)
Entropie roste, protože vzniká plyn a počet molekul se zvyšuje.
\(\ce{N_2} \left( g \right) + 3 \ce{H_2} \left( g \right) \rightarrow 2 \ce{NH_3} \left( g \right)\)
Entropie klesá, protože čtyři celkové molekuly reaktantu tvoří dvě celkové molekuly produktu. Všechny jsou plyny.
\(\ce{AgNO_3}) \left( aq \right) + \ce{NaCl} \left( aq \right) \rightarrow \ce{NaNO_3} \left( aq \right) + \ce{AgCl} \left( s \right)\)
Entropie klesá, protože z vodných reaktantů vzniká pevná látka.
\(\ce{H_2}) \levice( g \pravice) + \ce{Cl_2} \left( g \right) \rightarrow 2 \ce{HCl} \left( g \right)\)
Změna entropie není známa (ale pravděpodobně není nulová), protože na obou stranách rovnice je stejný počet molekul a všechny jsou plyny.