Atomový model
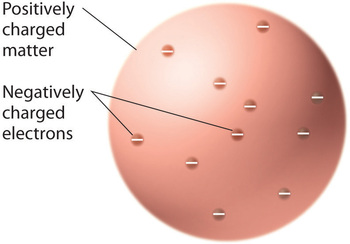
Když vědci dospěli k závěru, že veškerá hmota obsahuje záporně nabité elektrony, bylo jasné, že atomy, které jsou elektricky neutrální, musí obsahovat také kladné náboje, aby vyvážily ty záporné. Thomson navrhl, že elektrony jsou uloženy v jednotné kouli, která obsahuje jak kladný náboj, tak většinu hmotnosti atomu, podobně jako rozinky ve švestkovém pudinku nebo čokoládové lupínky v sušenkách (obrázek \(\PageIndex{9}\))
2.4.6
Obrázek \(\PageIndex{9}\): Thomsonův model atomu se švestkovým pudinkem nebo čokoládovou sušenkou. V tomto modelu jsou elektrony zasazeny do rovnoměrné koule s kladným nábojem. Obrázek použit s povolením (CC BY-SA-NC).
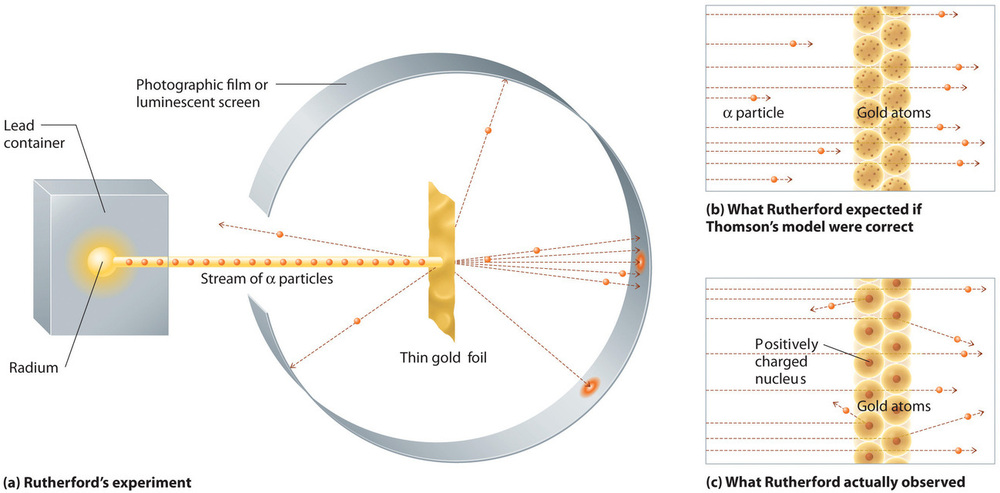
V jediném slavném experimentu však Rutherford jednoznačně prokázal, že Thomsonův model atomu je nesprávný. Rutherford namířil proud částic α na terč z velmi tenké zlaté fólie (obrázek \(\PageIndex{10a}\)) a zkoumal, jak jsou částice α fólií rozptylovány. Zlato bylo vybráno proto, že se dalo snadno zatlouct do extrémně tenkých plátů, čímž se minimalizoval počet atomů v terči. Pokud by Thomsonův model atomu byl správný, měly by kladně nabité částice α prorážet rovnoměrně rozloženou hmotu zlatého terče jako dělové koule stěnu dřevěného domu. Možná se při výstupu pohybovaly o něco pomaleji, ale v podstatě by měly terčem projít přímo (obrázek \(\PageIndex{10b}\))K Rutherfordovu úžasu se malá část částic α odrazila pod velkým úhlem a některé se odrazily přímo zpět ke zdroji (obrázek \(\PageIndex{10c}\). Podle Rutherforda „to bylo téměř tak neuvěřitelné, jako kdybyste vystřelili patnáctipalcovou střelu na kus hedvábného papíru a ona se vrátila a zasáhla vás.“
2.4.7
Obrázek \(\PageIndex{10}\): Souhrn Rutherfordových experimentů. (a) Vyobrazení přístroje, který Rutherford použil k detekci výchylek v proudu částic α namířených na tenký terčík ze zlaté fólie. Částice byly vytvářeny vzorkem radia. (b) Pokud by byl Thomsonův model atomu správný, měly částice α projít přímo skrz zlatou fólii. (c) Malý počet částic α se však odklonil různými směry, mimo jiné přímo zpět ke zdroji. To by mohlo být pravdivé pouze v případě, že by kladný náboj byl mnohem hmotnější než částice α. To naznačovalo, že hmotnost atomu zlata je soustředěna ve velmi malé oblasti prostoru, kterou nazval jádro. Obrázek použit se svolením (CC BY-SA-NC).
Rutherfordovy výsledky nebyly v souladu s modelem, v němž jsou hmotnost a kladný náboj rovnoměrně rozloženy v celém objemu atomu. Místo toho silně naznačovaly, že hmotnost i kladný náboj jsou soustředěny v malém zlomku objemu atomu, který Rutherford nazval jádro. Dávalo smysl, že malá část částic α se s hustými, kladně nabitými jádry sráží buď letmo, což vede k velkým výchylkám, nebo téměř čelně, což způsobuje jejich odraz přímo zpět ke zdroji.
Ačkoli Rutherford nedokázal vysvětlit, proč odpuzování mezi kladnými náboji v jádrech, která obsahují více než jeden kladný náboj, nezpůsobí rozpad jádra, usoudil, že odpuzování mezi záporně nabitými elektrony způsobí, že elektrony budou rovnoměrně rozloženy v celém objemu atomu. dnes je známo, že silné jaderné síly, které jsou mnohem silnější než elektrostatické interakce, drží protony a neutrony v jádře pohromadě. Za tento a další poznatky získal Rutherford v roce 1908 Nobelovu cenu za chemii. Bohužel Rutherford by raději obdržel Nobelovu cenu za fyziku, protože fyziku považoval za nadřazenou chemii. Podle jeho názoru je „celá věda buď fyzika, nebo sbírání známek“.
 2.4.8
2.4.8
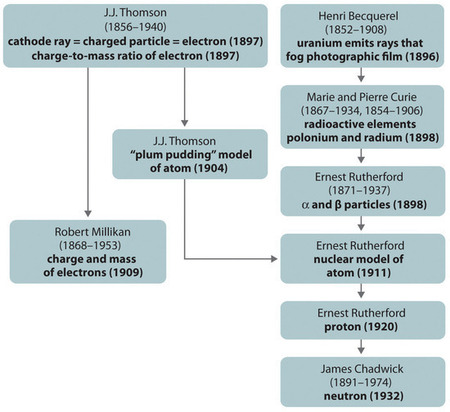
Obrázek \(\PageIndex{11}\): Přehled historického vývoje modelů složek a struktury atomu. Data v závorkách jsou roky, ve kterých byly provedeny klíčové experimenty. Obrázek použit s povolením (CC BY-SA-NC).
Historický vývoj různých modelů struktury atomu je shrnut na (Obrázek \(\PageIndex{11}\)). Rutherford zjistil, že jádro atomu vodíku je kladně nabitá částice, pro kterou v roce 1920 vymyslel název proton. Navrhl také, že jádra jiných prvků než vodíku musí obsahovat elektricky neutrální částice s přibližně stejnou hmotností jako proton. Neutron však byl objeven až v roce 1932, kdy jej objevil James Chadwick (1891-1974, Rutherfordův žák; Nobelova cena za fyziku, 1935). Díky Rutherfordově práci bylo jasné, že částice α obsahuje dva protony a neutrony, a je tedy jádrem atomu helia.
2.4.9
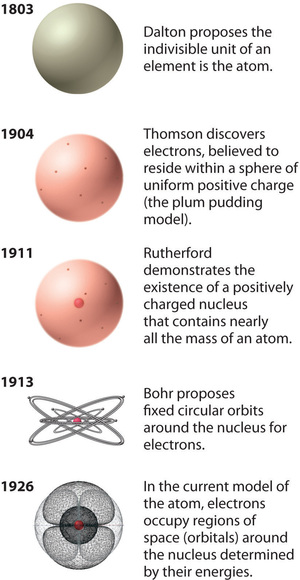
Obrázek \(\PageIndex{12}\): Vývoj atomové teorie znázorněný na modelech atomu kyslíku. Bohrův model a současný model jsou popsány v kapitole 6, „Struktura atomů“. Obrázek byl použit s povolením (CC BY-SA-NC).
Rutherfordův model atomu je v podstatě stejný jako současný model s tím rozdílem, že je nyní známo, že elektrony nejsou rovnoměrně rozloženy v celém objemu atomu. Místo toho jsou rozloženy podle souboru principů popsaných kvantovou mechanikou. Obrázek \(\PageIndex{12}\) ukazuje, jak se model atomu vyvíjel v průběhu času od Daltonovy nedělitelné jednotky k modernímu pohledu, který se vyučuje dnes.
.