
Brønsted ve své laboratoři
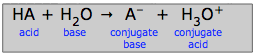
Podle Brønsted-Lowryho koncepce je proces, který byl dříve zapsán jako prostá disociace obecné kyseliny HA (HA → H+ + A-), správněji považován za proces přenosu protonu:
HA + H2O → A-+ H3O+(3-1)
Jde opět o to, že proton, jakmile opustí kyselinu, musí skončit navázaný na něco (co nazýváme bází); nemůže se prostě vznášet jako volný vodíkový ion.
- Konjugované páry kyseliny a zásady
- Silné kyseliny a slabé kyseliny
- Definice „silné“ kyseliny
- Vyrovnávací efekt
- Slabé kyseliny
- Silné kyseliny mají slabé konjugované báze
- Solky slabých kyselin se rozpouštějí za vzniku alkalických roztoků
- Jedinými běžnými silnými zásadami jsou hydroxidy 1. skupiny
- Slabé zásady dávají kyselé roztoky
- Autoprotolýza
- Amfolyty
- Soustava uhličitanových kyselin a zásad
Konjugované páry kyseliny a zásady
Reakce kyseliny se zásadou je tedy reakcí výměny protonů; pokud kyselinu označíme AH a zásadu B, pak můžeme zobecněnou acidobazickou reakci zapsat jako
AH + B → A- + BH+(3-2)
Všimněte si, že obrácená reakce,
BH+ + A- → B + AH(3-3)
je také acidobazickou reakcí. Protože reakce s přenosem protonu jsou vratné, vyplývá z toho, že přenosem protonu z kyseliny na zásadu musí nutně vzniknout nová dvojice druhů, které mohou alespoň v principu tvořit vlastní acidobazickou dvojici, kterou označujeme jako konjugovanou acidobazickou dvojici:
Termín konjugovaná znamená „spojená s“, z čehož vyplývá, že členy jakékoli konjugované dvojice jsou „spojeny“ přítomností nebo nepřítomností jednoho protonu.
Které druhy jsou považovány za „konjugované“, závisí na směru, ve kterém je reakce zapsána, jak je uvedeno níže pro přenos protonu v (3-1):


Podobně pro zobecněné přenosy protonu (3-2) a (3-3) máme


Následující tabulka uvádí konjugované páry řady typických acidobazických systémů.
| kyselina | zásada | ||
| kyselina chlorovodíková | HCl | chloridový ion | Cl- |
| kyselina octová | CH3CH2COOH | acetátový ion | CH3CH2COO- |
| kyselina dusičná | HNO3 | nitrátový iont | NO3- |
| dihydrogenfosforečnanový iont | H2PO4- | monohydrogenfosforečnanový ion | HPO42- |
| vodíkový síranový ion | HSO4- | síranový ion | SO42- |
| vodíkový ion uhličitanový („hydrogenuhličitanový“) ion | HCO3- | uhličitanový ion | CO32- |
| amonný ion | NH4+ | amoniak | NH3 |
| iont železa(III) („železitý“) | Fe(H2O)63+ | pentaaquoironIII | Fe(H2O)5OH2+ |
| voda | H2O | hydroxidový ion | OH- |
| hydroniový ion | H3O+ | voda | H2O |
Silné kyseliny a slabé kyseliny
Můžeme nahlížet na zobecněné kyseliny-zásadité reakce
jako soutěž dvou zásad o proton:

Definice „silné“ kyseliny
Pokud v tomto přetahování o proton drtivě zvítězí zásada H2O, pak se o kyselině HA říká, že je silnou kyselinou. To se děje u kyseliny chlorovodíkové a dalších běžných silných „minerálních kyselin“ H2SO4, HNO3 a HClO4:
Roztoky těchto kyselin ve vodě jsou ve skutečnosti roztoky iontových forem uvedených tučným písmem vpravo. Z toho vyplývá, že to, co nazýváme například 1 M roztokem „kyseliny chlorovodíkové“ ve vodě, ve skutečnosti vůbec neobsahuje významnou koncentraci HCl; jedinou skutečnou kyselinou přítomnou v takovém roztoku je H3O+!
Z těchto úvah vyplývají dvě důležitá pravidla, která je třeba nejen znát, ale také jim rozumět:
H3O+ je nejsilnější kyselina, která může ve vodě existovat;
Všechny silné kyseliny se ve vodě zdají být stejně silné.
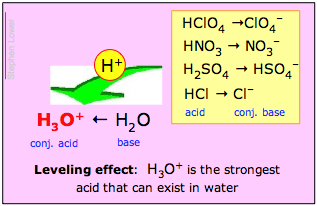
Druhé z těchto tvrzení se nazývá vyrovnávací efekt. Znamená, že ačkoli se vlastní proton-donorové síly silných kyselin liší, všechny jsou ve vodě zcela disociovány. Chemici říkají, že jejich síly jsou „vyrovnány“ rozpouštědlem – vodou.
Srovnatelný efekt by se projevil, kdybychom se pokusili posoudit síly několika dospělých osob tím, že bychom s malým dítětem provedli sérii soutěží v přetahování lanem. Dalo by se očekávat, že dospělí v každém pokusu drtivě zvítězí; jejich síly by byly „vyrovnány“ silami dítěte.
Slabé kyseliny
Většina kyselin je však schopna držet své protony pevněji, takže jen malá část kyseliny je disociována. Kyselina kyanovodíková, HCN, je tedy ve vodě slabou kyselinou, protože proton je schopen sdílet osamocené párové elektrony kyanidového iontu CN- účinněji než elektrony H2O, takže reakce
HCN + H2O → H3O+ + CN-
probíhá jen ve velmi malé míře.
Protože silná kyselina váže svůj proton jen slabě, zatímco slabá kyselina ho váže pevně, můžeme říci, že
Silné kyseliny jsou „slabé“; Slabé kyseliny jsou „silné“
Jestliže dokážete vysvětlit tento zdánlivý paradox, pochopili jste jednu z nejdůležitějších myšlenek acidobazické chemie!
|
reakce
|
kyselina
|
báze
|
konjugát kyseliny
|
konjugát báze
|
| 1) autoionizace vody H2O | H2O | H2O | H3O+ | OH- |
| 2) ionizace kyseliny kyanovodíkové HCN | HCN | H2O | H3O+ | CN- |
| 3) ionizace amoniaku NH3 ve vodě | NH3 | H2O | NH4+ | OH- |
| 4) hydrolýza chloridu amonného NH4Cl | NH4+ | H2O | H3O+ | NH3 |
| 5) hydrolýza octanu sodného CH3COO- Na+ | H2O | CH3COO- | CH3COOH | OH- |
| 6) neutralizace HCl pomocí NaOH | HCl | OH- | H2O | Cl- |
| 7) neutralizace NH3 kyselinou octovou | CH3COOH | NH3 | NH4+ | CH3COO- |
| 8) rozpouštění BiOCl (oxychloridu vizmutu) pomocí HCl | 2 H3O+ | BiOCl | Bi(H2O)3+ | H2O, Cl- |
| 9) rozklad Ag(NH3)2+ pomocí HNO3 | 2 H3O+ | Ag(NH3)2+ | NH4+ | H2O |
| 10) vytěsnění HCN CH3COOH | CH3COOH | CN- | HCN | CH3COO- |
Silné kyseliny mají slabé konjugované báze
To je jen revyjádření toho, co je implicitně obsaženo v tom, co bylo řečeno výše o rozdílu mezi silnými a slabými kyselinami. Skutečnost, že HCl je silná kyselina, znamená, že její konjugovaná báze Cl- je příliš slabá báze na to, aby udržela proton v konkurenci s H2O nebo H3O+. Podobně iont CN- se silně váže na proton, takže HCN je slabá kyselina.
Solky slabých kyselin se rozpouštějí za vzniku alkalických roztoků
Ze skutečnosti, že HCN je slabá kyselina, vyplývá, že kyanidový iont CN- snadno reaguje s protony, a je tedy relativně dobrou zásadou. Důkazem toho je, že sůl jako KCN po rozpuštění ve vodě dává mírně zásaditý roztok:
CN- + H2O → HCN + OH-
Tato reakce se stále ještě někdy označuje starým názvem hydrolýza („štěpení vody“), což je doslova správné, ale má tendenci zastírat její identitu jako další acidobazické reakce. Reakce tohoto typu probíhají pouze v malém rozsahu; 0,1M roztok KCN je pro všechny praktické účely stále 0,1M v kyanidovém iontu.
Jedinými běžnými silnými zásadami jsou hydroxidy 1. skupiny
Jedinými skutečně silnými zásadami, se kterými se v každodenní chemii pravděpodobně setkáte, jsou hydroxidy alkalických kovů, jako jsou NaOH a KOH, což jsou v podstatě roztoky hydroxidového iontu (a samozřejmě kationtu.)
Většina ostatních sloučenin obsahujících hydroxidové ionty, jako jsou Fe(OH)3 a Ca(OH)2, není ve vodě dostatečně rozpustná, aby vznikly vysoce alkalické roztoky, a proto se o nich obvykle neuvažuje jako o silných zásadách.
Ve skutečnosti existuje řada zásad, které jsou silnější než hydroxidový ion – nejznámější jsou oxidový ion O2- a amidový ion NH2-, které jsou však tak silné, že mohou vodu připravit i o proton:
O2- + H2O → 2 OH-
NH2- + H2O → NH3 + OH-
Dochází tak ke stejnému vyrovnávacímu efektu, jaký jsme popsali u kyselin, což má za následek, že
Slabé zásady dávají kyselé roztoky
Nejběžnějším příkladem je chlorid amonný, NH4Cl, jehož vodné roztoky jsou výrazně kyselé:
NH4+ + H2O → NH3 + H3O+
Protože tato (a podobné) reakce probíhají jen v malé míře, bude roztok chloridu amonného jen mírně kyselý.
Autoprotolýza
Z některých výše uvedených příkladů, vidíme, že voda může působit jako kyselina
CN- + H2O → HCN + OH-
a jako zásada
NH4+ + H2O → NH3 + H3O+
Je-li tomu tak, pak není důvod, proč by „voda-kyselina“ nemohla darovat proton „vodě-základě“:

Tato reakce je známá jako autoprotolýza vody.
Chemisté tuto reakci stále často označují jako „disociaci“ vody a jako určitou zkratku používají Arrheniovu rovnici H2O → H+ + OH-.
Jak bylo řečeno v předchozí lekci, k tomuto procesu dochází jen v nepatrné míře. Znamená to však, že v každém vodném roztoku jsou přítomny jak hydroniové, tak hydroxidové ionty.
Mohou autoprotolýzu vykazovat i jiné kapaliny? Odpověď zní ano. Nejznámějším příkladem je kapalný amoniak:
2 NH3 → NH4+ + NH2-
Tuto hru může hrát i čistá kapalná kyselina sírová:
2 H2SO4→ H3SO4+ + HSO4-
Každý z těchto roztoků může být základem vlastního acidobazického „systému“, paralelně se známým „systémem vody“.
Amfolyty
O vodě, která může působit jako kyselina nebo zásada, se říká, že je amfiprotická: může „kmitat oběma směry“. Látka, jako je voda, která je amfiprotická, se nazývá amfolit.
Jak je zde uvedeno, hydroxidový ion může být také amfolitem, ale ne ve vodném roztoku, ve kterém nemůže existovat oxidový ion.
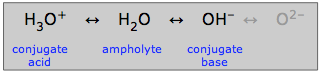
Je to samozřejmě amfiprotická povaha vody, která jí umožňuje hrát zvláštní roli v běžné vodní acidobazické chemii. Ve vodných roztocích však může existovat i mnoho dalších amfiprotických látek. Každá taková látka bude mít vždy konjugovanou kyselinu a konjugovanou zásadu, takže pokud dokážete rozpoznat tyto dva konjugáty látky, poznáte, že je amfiprotická.
Soustava uhličitanových kyselin a zásad
Například trojice {kyselina uhličitá, hydrogenuhličitanový ion, uhličitanový ion} tvoří amfiprotní řadu, v níž je hydrogenuhličitanový ion amfolitem, který se od některého ze svých sousedů liší přidáním nebo odebráním jednoho protonu:
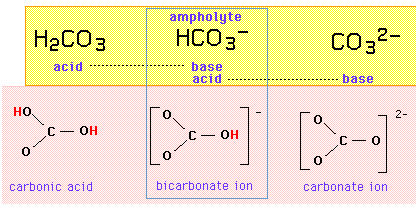
Je-li hydrogenuhličitanový ion kyselinou i zásadou, měl by být schopen vyměnit si sám se sebou jeden proton v reakci autoprotolýzy:
HCO3- + HCO3- → H2CO3 + CO32-
Na výše uvedené reakci závisí váš život! CO2, vedlejší metabolický produkt každé buňky ve vašem těle, reaguje s vodou za vzniku kyseliny uhličité
H2CO3, která by při svém nahromadění způsobila smrtelnou kyselost vaší krve. Krev však obsahuje také uhličitanové ionty, které reagují podle obrácené výše uvedené rovnice za vzniku hydrogenuhličitanu, který může být krví bezpečně přenesen do plic. V plicích probíhá reakce autoprotolýzy v přímém směru, přičemž vzniká H2CO3, který ztrácí vodu za vzniku CO2, který se vylučuje s dechem. Uhličitanový iont je recyklován zpět do krve, aby nakonec nabral další molekulu CO2.