Chemický prvek helium se řadí mezi vzácné plyny a nekovy. Byl objeven v roce 1895 Williamem Ramsayem.

Datová zóna
| Klasifikace: | Helium je vzácný plyn a nekov |
| Barva: | bezbarvý |
| Atomová hmotnost: | 4.00260 |
| Stav: | plyn |
| Teplota tání: | -272,2 oC, 0,95 K |
| Poznámka: Při normálním atmosférickém tlaku helium netuhne, a proto nemá teplotu tání. Výše uvedená teplota tání je při tlaku 25 atmosfér. | |
| Teplota varu: | -268,9 oC, 4 K.2 K |
| Elektrony: | 2 |
| Protony: | 2 |
| Neutrony v nejhojnějším izotopu: | 2 |
| Elektronové obaly: | 2 |
| Elektronová konfigurace: | 1s2 |
| Hustota při 20oC: | 0.0001787 g/cm3 |
Zobrazit více, včetně: Teploty, energie, oxidace,
reakce, sloučeniny, poloměry, vodivosti
| Objem atomu: | 27,2 cm3/mol |
| Struktura: | obvykle hexagonální těsně zabalená |
| (v.vysoký tlak potřebný k tuhnutí helia) | |
| Specifická tepelná kapacita | 5,193 J g-1 K-1 |
| Teplota tání | 0.0138 kJ mol-1 |
| Teplo atomizace | 0 |
| Teplo vypařování | 0.0845 kJ mol-1 |
| 1. ionizační energie | 2372.3 kJ mol-1 |
| 2. ionizační energie | – |
| 3. ionizační energie | – |
| Elektronová afinita | 0 kJ mol-.1 |
| Minimální oxidační číslo | 0 |
| Min. běžné oxidační číslo | 0 |
| Maximální oxidační číslo | 0 |
| Maximální běžné oxidační číslo. | 0 |
| Elektronegativita (Paulingova stupnice) | – |
| Polarizační objem | 0.198 Å3 |
| Reakce se vzduchem | žádná |
| Reakce s 15 M HNO3 | žádná |
| Reakce s 6. M HCl | žádný |
| Reakce s 6 M NaOH | žádný |
| Oxid(y) | žádný |
| Hydrid(y) | žádný |
| Chlorid(y) | žádný |
| Atomový poloměr | 31 pm |
| Iontový poloměr (1+ iont) | |
| – | |
| Iontový poloměr (2+ ion) | – |
| Iontový poloměr (3+ ion) | – |
| Iontový poloměr (1- ion) | – |
| Iontový poloměr (2- ion) | – |
| Iontový poloměr (3- ion) | – |
| Tepelná vodivost | 0.15 W m-1 K-1 |
| Elektrická vodivost | – |
| Teplota tuhnutí/topení: | -272,2 oC, 0.95 K |

Nasa: Ionizované atomy helia o teplotě přibližně 60 000 °C v chromosféře Slunce vyzařují ultrafialové světlo, které je vidět na tomto snímku.
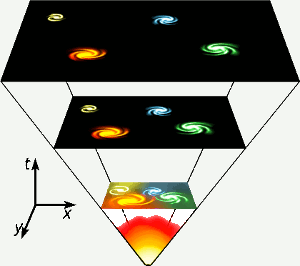
Hélium vzniklo v prvních třech minutách existence vesmíru, kdy byly všude dostatečně vysoké teploty, aby mohla probíhat jaderná fúze. Tato krátká, vysokoenergetická fáze je znázorněna úplně dole na diagramu. Helium vzniká také jadernou fúzí vodíku ve hvězdách, jako je ta naše. Obrázek: Gnixon
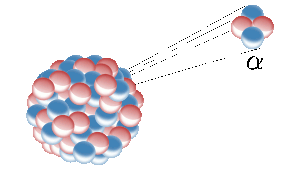
Helium na Zemi vzniká jaderným štěpením radioaktivních prvků, jako je uran. Radioaktivní jádro zde vyzařuje jádro helia (známé také jako částice alfa). Obrázek: Inductiveload

Spektrum helia s výraznou žlutou čarou. Obrázek: Nasa

William Ramsay ukazuje na poslední sloupec periodické tabulky obsahující vzácné (nebo inertní) plyny. Za objev inertních plynů získal Ramsay v roce 1904 Nobelovu cenu za chemii. Obrázek: Doug Stewart
Příběh objevu helia se prolíná s objevem podstaty hvězd.
Kdysi se lidé domnívali, že se nikdy nedozvíme, z čeho se hvězdy skládají. V roce 1835 francouzský filozof Auguste Comte prohlásil, že „nikdy nebudeme schopni žádným způsobem studovat jejich chemické složení“. (1)
Comte se domníval, že se dozvíme, z čeho se skládají hvězdy, pouze pokud se nám je podaří dostat do laboratoře.
Navzdory Comtovu pesimismu již byla nalezena metoda, jak objevit helium a složení hvězd. V roce 1814 převzal německý fyzik Joseph Fraunhofer metodu Isaaca Newtona, která spočívala v rozdělení slunečního světla pomocí hranolu, a učinil zásadní pokrok. Fraunhofer si všiml tmavých čar v duhovém spektru barev vycházejících ze slunečního světla rozděleného hranolem; čáry, které viděl, byly vůbec prvním pozorováním hvězdného spektra. (2), (3)
V letech 1859/60 udělali němečtí vědci Gustav Kirchhoff a Robert Bunsen obrovský skok ve vědě o spektroskopii, včetně objevu, že tmavé čáry, které Fraunhofer viděl, jsou jako otisk prstu látky.
Byla připravena půda pro to, aby Kirchhoff a Bunsen objevili nové prvky studiem světla z látek při jejich hoření.
V roce 1860 objevili cesium podle jeho modrých spektrálních čar a v roce 1861 rubidium podle dvou červených spektrálních čar. William Crookes pak v roce 1861 objevil thallium po pozorování jasně zelené spektrální čáry.
Kirchhoff a Bunsen zkoumali spektrum Slunce a došli k závěru, že v jeho žhavé atmosféře je přítomno železo. (4)
K objevu helia bylo potřeba ještě několik let. V srpnu 1868 mělo nastat první úplné zatmění od zveřejnění Kirchhoffovy a Bunsenovy práce.
Francouzský astronom Pierre Janssen čekal na zatmění, aby mohl pomocí spektroskopu pozorovat protuberance ve sluneční koróně. Během dvou týdnů po zatmění Janssen vyvinul metodu záznamu spekter protuberancí bez nutnosti zatmění. V těchto spektrech pozoroval žlutou čáru. (5)
Čára se nacházela v podobné, nikoli však totožné poloze jako čáry ve spektru sodíku. Nazval je čarami D1 a D2. Novou žlutou čáru studoval anglický vědec Norman Lockyer; později se bude nazývat čára D3. svou studii čáry zveřejnil s vědomím, že by mohla být způsobena novým prvkem:
„…takže jsme tehdy věděli, že nemáme co do činění s vodíkem; tudíž jsme měli co do činění s prvkem, který jsme nemohli získat v našich laboratořích, a proto jsem na sebe vzal zodpovědnost za vytvoření slova helium, v první řadě pro laboratorní použití.“ [6 (6)
Název helium pochází z řeckého slova pro slunce, helios.
Lockyer a jeho spolupracovník Edward Frankland měli řadu jiných představ o možných příčinách žluté čáry, a proto nový prvek neoznámili.
V roce 1871 si již ostatní vědci uvědomovali situaci. Lord Kelvin diskutoval o „odrazu světla žhavého vodíku a ‚helia‘ kolem Slunce“. Po použití slova „helium“ následuje vysvětlující poznámka pod čarou:
„Frankland a Lockyer zjistili, že žluté protuberance dávají velmi rozhodnou jasnou čáru nedaleko od D, která však dosud nebyla ztotožněna s žádným pozemským plamenem. Zdá se, že ukazuje na novou látku, kterou navrhují nazvat hélium.“ (7)
Existenci helia však nepřijali všichni. (5)
Všechny pochybnosti byly rozptýleny, když skotský chemik William Ramsay v roce 1895 v Londýně helium izoloval. Ramsay předtím v roce 1894 spoluobjevil argon; argon byl prvním z objevených vzácných plynů. V roce 1895 si přečetl článek Williama Hillebranda popisující nereaktivní plyn, který se uvolňoval po přidání kyseliny k uranovému minerálu, uranitu. Hillebrand se domníval, že jde o dusík.
Ramsay, který se domníval, že by plyn mohl obsahovat argon, zopakoval Hillebrandův pokus s použitím jiného uranového minerálu, cleveitu, a plyn zachytil.
Jeho spektroskop ukázal přítomnost dusíku, argonu a jednoho dalšího plynu. Ramsay měl podezření, že by to mohlo být helium, protože se objevila čára D3. (8) Protože věděl, že Lockyer a William Crookes mají lepší spektroskop než on, poslal jim vzorek plynu. Bohužel vzorek nebyl vhodný, a tak Lockyer získal vzorek uranitu, plyn extrahoval a studoval ho spektroskopem. Píše: (8)
„Jedna po druhé se ukázalo, že neznámé čáry, které jsem pozoroval na Slunci v roce 1868, patří plynu.“
Spektrum plynu bylo totožné se slunečním „heliem“. Nový prvek získal své místo v periodické tabulce prvků.
Navštivte stránku Chemicool’s Cool Helium Facts.

Vzhled a vlastnosti
Škodlivé účinky:
Není známo, že by helium bylo toxické.
Vlastnosti:
Helium je lehký, bezbarvý, inertní, jednoatomový plyn bez zápachu. Může tvořit dvouatomové molekuly, ale jen slabě a při teplotách blízkých absolutní nule.
Helium má nejnižší teplotu tání ze všech prvků a jeho teplota varu se blíží absolutní nule.
Na rozdíl od jiných prvků helium netuhne, ale zůstává kapalné až do absolutní nuly (0 K) za běžných tlaků.
Hlas člověka, který se dočasně nadýchal helia, zní vysoko.
Použití helia
Největším uživatelem helia je magnetická rezonance (MRI). Hélium se používá k chlazení supravodivých magnetů skenerů MRI.
Helium se používá k plnění balónů (vzducholodí) a k natlakování raket na kapalné palivo.
Směsi helia a kyslíku se používají jako umělý „vzduch“ pro potápěče a další osoby pracující pod tlakem. Helium se používá místo dusíku v normálním vzduchu, protože po dlouhém ponoru helium opouští tělo rychleji než dusík, což umožňuje rychlejší dekompresi.
Helium se používá jako ochranný plyn v blízkosti svařovacího oblouku, který zabraňuje například jakékoliv reakci horkých kovových svarů s kyslíkem. Tento plyn se používá v polovodičovém průmyslu k zajištění inertní atmosféry pro pěstování krystalů křemíku a germania. Používá se také jako vysokoteplotní plyn při výrobě titanu a zirkonia a jako nosný plyn v plynové chromatografii.
Výskyt a izotopy
Výskyt v zemské kůře: 8 hmotnostních dílů na miliardu, 43 molů na miliardu
Výskyt ve sluneční soustavě: 23 % hmotnostních, 7,4 % molů
Cena, čistý: 5,2 USD na 100 g
Cena, volně ložený: 1 USD na 100 g
Zdroj: ČHMÚ: Téměř veškeré helium na Zemi je výsledkem radioaktivního rozpadu. Hlavní zdroje helia pocházejí z ložisek zemního plynu ve vrtech v Texasu, Oklahomě a Kansasu. Helium se získává frakční destilací zemního plynu, který obsahuje až 7 % helia.
Izotopy: Helium má 8 izotopů s hmotnostními čísly 3 až 10, jejichž poločasy rozpadu jsou známy. Přirozeně se vyskytující helium je směsí svých dvou stabilních izotopů, 3He a 4He s přirozeným zastoupením 0,0001 % a 99,999 %.

- Auguste Comte, Cours de Philosophie Positive na Project Gutenberg
- Keith J. Laidler, The World of Physical Chemistry, 1993, s179.
- The Era of Classical Spectroscopy, z anglického originálu MIT Spectroscopy.
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics. 1984, Elsevier Science Publishers, s211
- Helge Kragh, The Solar Element: A Reconsideration of Helium’s Early History., 2009, Annals of Science, 66:2, s157-182.
- J. Norman Lockyer, The Growth of our Knowledge of Helium., Science Progress, 1896, Vol 5., s249
- W. Thomson, Presidential Address, British Association for the Advancement of Science, 1871, (Address. XCIX)
- Sir Norman Lockyer, The Sun’s Place in Nature (Místo Slunce v přírodě), 1897, s. 47-48
Citujte tuto stránku
Pro online odkazování zkopírujte a vložte jednu z následujících možností:
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
nebo
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
Chcete-li tuto stránku citovat v akademickém dokumentu, použijte následující citaci v souladu s MLA:
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.
.