Termíny luminiscence, fotoluminiscence, fluorescence a fosforescence se běžně používají ve výzkumných pracích k popisu emise světla ze vzorku. Toto vícenásobné pojmenování může být matoucí, protože některé z termínů se používají zaměnitelně a vědci z různých vědeckých oborů dávají přednost používání jednoho názvu před druhým. V tomto článku odpovídáme na otázku: „Jaký je rozdíl mezi luminiscencí, fotoluminiscencí, fluorescencí a fosforescencí?“
Co je to luminiscence?
Luminiscence je jakákoli emise světla (elektromagnetického vlnění) z látky, která nevzniká zahříváním. Touto definicí se luminiscence liší od inkandescence, což je vyzařování světla v důsledku zvýšené teploty látky, například žhavého uhlíku. Slovo luminiscence je odvozeno z latinského slova pro světlo, lumen, a latinského slova escentia, což znamená „proces“, a je to tedy proces vyzařování světla.

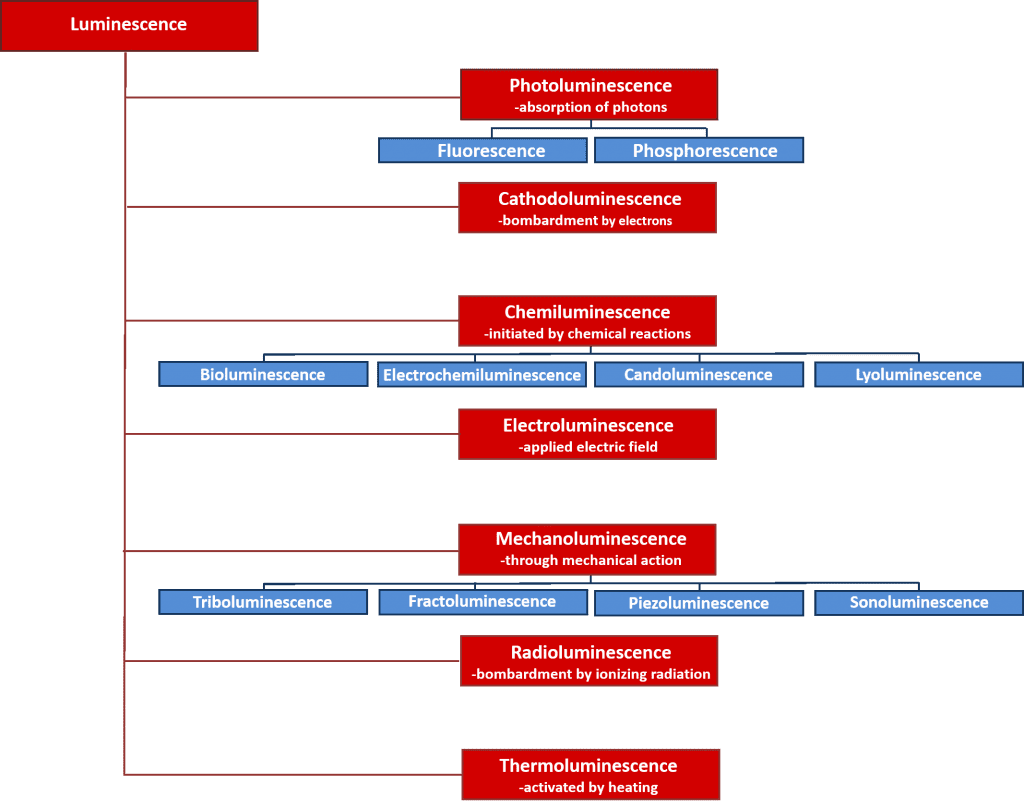
Existuje mnoho typů luminiscence, které lze klasifikovat podle zdroje energie, který proces luminiscence iniciuje. Přehled různých typů luminiscence a jejich zdrojů energie je uveden na obrázku 2. Mnohé z těchto luminiscenčních procesů mají důležité vědecké a průmyslové využití, např. elektroluminiscence, při níž je světlo emitováno při rekombinaci elektronů a děr po působení elektrického pole na materiál a která je principem činnosti světelných diod, a chemiluminiscence, při níž je emise světla iniciována chemickou reakcí a používá se při biologických testech a je zodpovědná za svítící tyčinky. Tento článek se však zaměřuje na fotoluminiscenci, která tvoří základ výkonné nedestruktivní spektroskopické techniky, fotoluminiscenční spektroskopie, která se hojně využívá v akademickém i průmyslovém prostředí.
Co je fotoluminiscence?
Fotoluminiscence je emise světla z materiálu po absorpci světla. Slovo samo o sobě je zajímavé tím, že jde o kombinaci latinského odvozeného slova luminiscence a řecké předpony foto-, která znamená světlo. Jakákoli luminiscence, která je vyvolána absorpcí fotonů, se nazývá fotoluminiscence. Stejně tak se může jednat o emisi světla z molekuly organického barviva v roztoku (obrázek 3a) nebo o pásmovou rekombinaci elektronů a děr po fotoexcitaci polovodiče (obrázek 3b).

Popisovat jakoukoli emisi světla vyvolanou absorpcí fotonů jako fotoluminiscenci je přesné, nicméně běžnou praxí, zejména u chemiků, je fotoluminiscenci dále dělit na fluorescenci a fosforescenci.
Jaký je rozdíl mezi fluorescencí a fosforescencí?
Existují různé definice fluorescence a fosforescence, přičemž nejjednodušší je, že fluorescence je pohotová fotoluminiscence, která nastává velmi krátce po fotoexcitaci látky, zatímco fosforescence je dlouhodobá fotoluminiscence, která pokračuje ještě dlouho po ukončení fotoexcitace. Ačkoli je to jednoduchá definice, nevysvětluje, proč dochází k takovému rozdílu v časových škálách fotoluminiscence, a některé materiály mohou spadat do šedé zóny mezi klasickými časovými škálami fluorescence a fosforescence. Důkladnější definice musí vycházet z kvantové mechaniky excitovaných a základních stavů zapojených do procesu emise. Pomocí tohoto přístupu lze fluorescenci a fosforescenci definovat jako fotoluminiscenci, kde zářivý přechod nevyžaduje změnu spinové multiplicity, a fotoluminiscenci, kde zářivý přechod zahrnuje změnu spinové multiplicity.
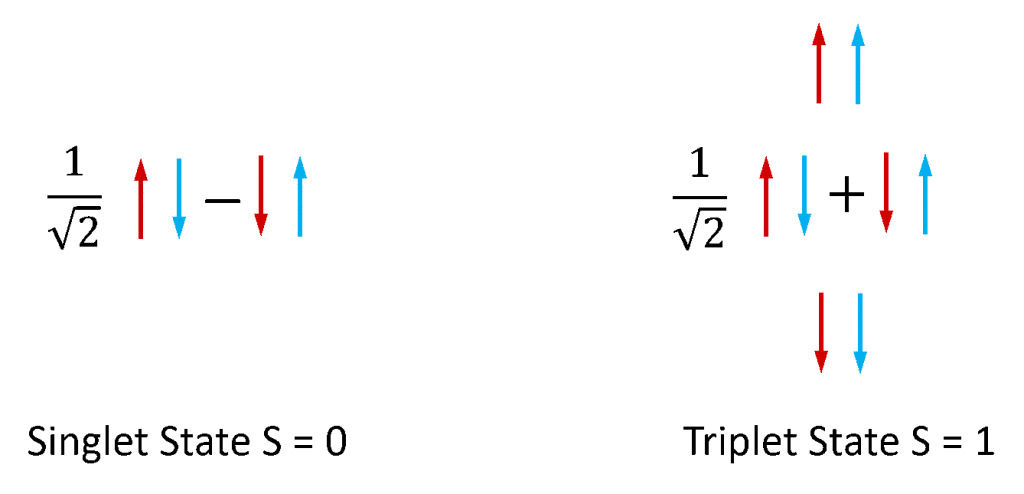
Fluorescence a fosforescence se nejčastěji používají pro označení fotoluminiscence z molekulárních systémů. Elektrony ve stabilních molekulách existují vždy v párech, protože molekuly s nepárovými elektrony jsou extrémně reaktivní a nestabilní. Elektrony mají vlastní úhlový moment hybnosti známý jako „spin“ a pár elektronů může existovat v jednom ze dvou celkových spinových stavů v závislosti na relativní symetrii spinů obou elektronů. Pokud jsou oba spiny v antisymetrické konfiguraci, má elektronový pár celkový spin nula (S = 0), zatímco pokud jsou v symetrické konfiguraci, má pár celkový spin jedna (S = 1). Jak je znázorněno na obrázku 4, existuje jedna kombinace stavů spinového páru elektronů, která je antisymetrická, a tři kombinace stavů spinového páru, které jsou symetrické, a stavy S = 0 a S = 1 se proto nazývají singlet, resp. triplet.
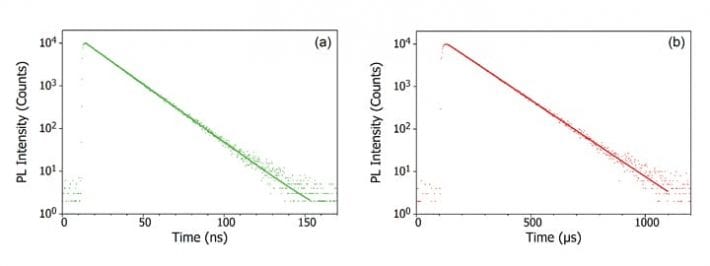
Při absorpci fotonu molekulou je jeden z elektronů povýšen na vyšší energetickou hladinu a molekula je nyní v excitovaném stavu. Základní stav molekuly je (téměř) vždy singletový stav (S0) a vzhledem k zachování momentu hybnosti musí být fotoexcitovaný stav také singletový (S1), jak ukazuje Jablonského diagram níže. Rozpad stavu S1 zpět na S0 je povolený přechod (protože oba stavy mají stejnou spinovou multiplicitu), jehož výsledkem je okamžitá fotoluminiscence, která se projevuje v časové škále pikosekund až nanosekund a nazývá se fluorescence.
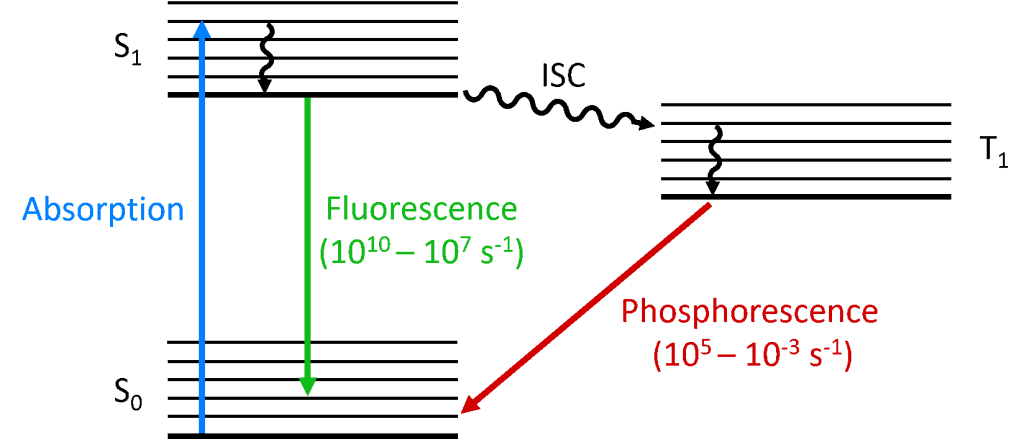
Alternativně může molekula podstoupit přechod mezi systémy (ISC) do excitovaného tripletového stavu (T1). K ISC typicky dochází u molekul s vysokým stupněm spin-orbitální vazby, tedy vazby orbitálního úhlového momentu hybnosti a spinového úhlového momentu hybnosti elektronu, která umožňuje konverzi mezi singletovým a tripletovým stavem. Síla spin-orbitální vazby roste s hmotností atomu, a fosforeskující molekuly proto musí obsahovat těžké kovy, jako je europium a iridium. Rozpad stavu T1 zpět na S0 je zakázaný přechod, protože tyto stavy mají v důsledku zachování momentu hybnosti různou spinovou násobnost. Spin-orbitální vazba však toto omezení uvolňuje a zářivý přechod ze stavu T1 do S1 je možný. Protože je „zakázaný“, fotoluminiscence, která je výsledkem přechodu T1 do S0, probíhá na mnohem pomalejší časové škále, od mikrosekund po tisíce sekund, a nazývá se fosforescence.
Je třeba také poznamenat, že emise některých materiálů nepatří vždy přesně do jedné nebo druhé kategorie. Příkladem je tepelně aktivovaná opožděná fluorescence (TADF). Při TADF jsou hladiny S1 a T1 energeticky blízké a silně spřažené, a proto je možná zpětná ISC z T1 do S1. To vede ke zpožděnému přechodu S1 do S0, který má za následek fotoluminiscenci v časové škále mezi fluorescencí a fosforescencí, známou jako zpožděná fluorescence. Další informace o TADF a jejím použití ve vysoce účinných OLED najdete v příspěvku „Co je TADF?“.
Kdy popsat emisi jako fotoluminiscenci a kdy jako fluorescenci/fosforescenci, záleží nakonec na osobních preferencích. Chemici a biologové, kteří studují především molekulární systémy, dávají přednost používání fluorescence a fosforescence, protože v těchto vysoce lokalizovaných molekulárních systémech existují odlišné singletové a tripletové stavy. Naproti tomu fyzikové studují převážně polovodičové materiály, kde jsou elektrony vysoce delokalizované a pojem singlet a triplet často ztrácí význam. To je jeden z důvodů, proč mají fyzikové tendenci používat pro popis světelné emise širší termín fotoluminiscence.
Ať už se rozhodnete pro jakýkoli název, fotoluminiscence, fluorescence a fosforescence mohou poskytnout řadu informací o vlastnostech molekul a materiálů; od stanovení doby života nosičů náboje v solárních článcích až po měření dynamiky solvatace v okolí micel v živých buňkách.
Produkty pro luminiscenci, fotoluminiscenci, fluorescenci a fosforescenci
K měření fotoluminiscence je zapotřebí fotoluminiscenční spektrometr a Edinburgh Instruments nabízí řadu fotoluminiscenčních spektrometrů s počítáním jednotlivých fotonů pro měření fotoluminiscenčních spekter, dob života, anizotropie a kvantových výtěžků vašich vzorků.
Zůstaňte v kontaktu
Pokud se vám tento článek líbil a chcete být první, kdo se dozví o všech novinkách, aplikacích a informacích o produktech společnosti Edinburgh Instruments, přihlaste se k odběru našeho nepravidelného zpravodaje prostřednictvím červeného tlačítka níže a sledujte nás na sociálních sítích.