Molekulová geometrie ve tvaru T popisuje v chemii struktury některých molekul, v nichž má centrální atom tři ligandy. Obvykle mají tříkoordinované sloučeniny trigonální planární nebo pyramidální geometrii. Příkladem molekul ve tvaru T jsou trifluoridy halogenů, například ClF3.
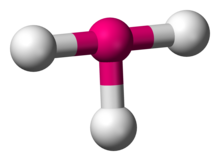
ClF3
C2v
90°, 180°
>0

Podle teorie VSEPR geometrie ve tvaru T vzniká, když jsou k centrálnímu atomu vázány tři ligandy a dva osamělé páry elektronů, zapsané v notaci AXE jako AX3E2. Geometrie ve tvaru T je příbuzná trigonální bipyramidální molekulové geometrii pro molekuly AX5 se třemi ekvatoriálními a dvěma axiálními ligandy. V molekule AX3E2 zaujímají dva osamělé páry dvě ekvatoriální polohy a tři atomy ligandu zaujímají dvě axiální polohy a jednu ekvatoriální polohu. Tyto tři atomy se vážou pod úhlem 90° na jedné straně centrálního atomu, čímž vzniká tvar T.
Trifluoroxenátový(II) aniont, XeF-
3, byl zkoumán jako možný první příklad molekuly AX3E3, u které by se podle úvah VSEPR dalo očekávat, že bude mít šest elektronových párů v oktaedrickém uspořádání s orientací jak tří osamělých párů, tak tří ligandů ve tvaru mer nebo T. Molekula AX3E3 se nachází v osmistěnném uspořádání. Ačkoli byl tento aniont detekován v plynné fázi, pokusy o syntézu v roztoku a experimentální určení struktury byly neúspěšné. Studie výpočetní chemie ukázala zkreslenou planární geometrii ve tvaru Y s nejmenším vazebným úhlem F-Xe-F rovným 69°, nikoli 90° jako v geometrii ve tvaru T.
.