Los colorantes se utilizan en muchas industrias: para colorear la ropa, las pinturas, los plásticos, las fotografías, los grabados y la cerámica. Los colorantes también se utilizan ahora en nuevas aplicaciones y se denominan funcionales (de alta tecnología), ya que no sólo se incluyen en el producto por razones estéticas, sino con fines específicos, por ejemplo en cirugía.
Los colorantes pueden ser tintes o pigmentos. Los tintes son compuestos orgánicos coloreados solubles que suelen aplicarse a los textiles a partir de una solución en agua. Están diseñados para unirse fuertemente a las moléculas de polímero que componen la fibra textil.
Los pigmentos son compuestos insolubles que se utilizan en pinturas, tintas de impresión, cerámica y plásticos. Se aplican mediante una dispersión en un medio adecuado. La mayoría de los pigmentos utilizados son también compuestos orgánicos.
- Manipulación del color y aplicación de los tintes
- La coloración de los textiles
- Clasificación de los colorantes
- Clasificación de colorantes por su estructura química
- (a) Tintes azoicos
- (b) Tintes de antraquinona
- (c) Ftalocianinas
- Clasificación de los colorantes por métodos de aplicación
- Colorantes del grupo 1
- (i) Colorantes ácidos
- (ii) Colorantes de complejos metálicos
- (iii) Colorantes directos
- (iv) Tintes básicos
- (v) Colorantes dispersos
- Colorantes del grupo 2
- i) Colorantes reactivos
- (ii) Tintes de cuba
- (iii) Tintes de azufre
- Pigmentos
- Colores y pigmentos funcionales (de alta tecnología)
- (a) Pantallas de cristal líquido
- (b) Tintes láser
- (c) Impresión por chorro de tinta
- (d) Terapia fotodinámica
Manipulación del color y aplicación de los tintes
Esta sección considera parte de la química que hay detrás del color de los tintes y cómo el material de destino, por ejemplo una fibra, influye en el método de teñido y en el tinte utilizado.
Un tinte en solución se colorea debido a la absorción selectiva de ciertas longitudes de onda de la luz por enlaces específicos en la molécula. La luz que se transmite es vista por el observador y aparece coloreada porque algunas de las longitudes de onda del espectro visible se pierden.

Figura 1 La malva fue el primer tinte sintético de la historia. Fue producido accidentalmente por William Perkin en 1856, que intentaba sintetizar la quinina. Se hizo especialmente popular cuando la reina Victoria lució un vestido de seda teñido con malva en la Exposición Real de 1862 en Londres.
Con la amable autorización de la Sociedad de Tintoreros y Coloristas.
La absorción de la energía de la luz visible por parte del compuesto promueve los electrones de la molécula desde un estado de baja energía, el estado básico, a un estado de mayor energía, el estado excitado. Se dice que la molécula ha sufrido una transición electrónica durante este proceso de excitación. Las energías de excitación particulares corresponden a determinadas longitudes de onda de la luz visible.
Es un electrón n (un electrón en un enlace doble o triple) el que es promovido al estado excitado. Se requiere incluso menos energía para esta transición si en la misma molécula existen enlaces simples y dobles alternos (es decir, dobles enlaces conjugados). La excitación del electrón se ve facilitada por la presencia de anillos aromáticos debido a la mayor deslocalización de los n electrones.
Alterando la estructura del compuesto, los químicos del color pueden modificar la longitud de onda de la luz visible absorbida y, por tanto, el color del compuesto.
Las moléculas de la mayoría de los compuestos orgánicos coloreados contienen dos partes:
(i) un único anillo aril (aromático) como el benceno o un anillo bencénico con un sustituyente. Alternativamente, puede haber un sistema de anillos fusionados, como el naftaleno (dos anillos fusionados) o el antraceno (tres anillos fusionados).
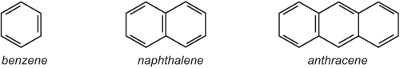
Donde los anillos se unen, comparten dos átomos de carbono y, por tanto, el naftaleno con dos anillos tiene 10 átomos de carbono, no 12. Del mismo modo, el antraceno tiene 14 átomos de carbono en lugar de 18. Como el naftaleno y el antraceno contienen electrones deslocalizados en todos los anillos, no es apropiado utilizar el símbolo de deslocalización que se usa para el benceno en las otras unidades, ya que eso indicaría dos o tres sistemas deslocalizados separados. Por lo tanto, en esta unidad se utilizan las estructuras Kekule.
(ii) un extenso sistema de doble enlace conjugado que contiene grupos insaturados, conocidos como cromóforos, como:
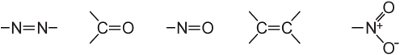
La intensidad del color puede aumentarse en una molécula de colorante mediante la adición de sustituyentes que contengan pares de electrones solitarios al anillo arilo, como:
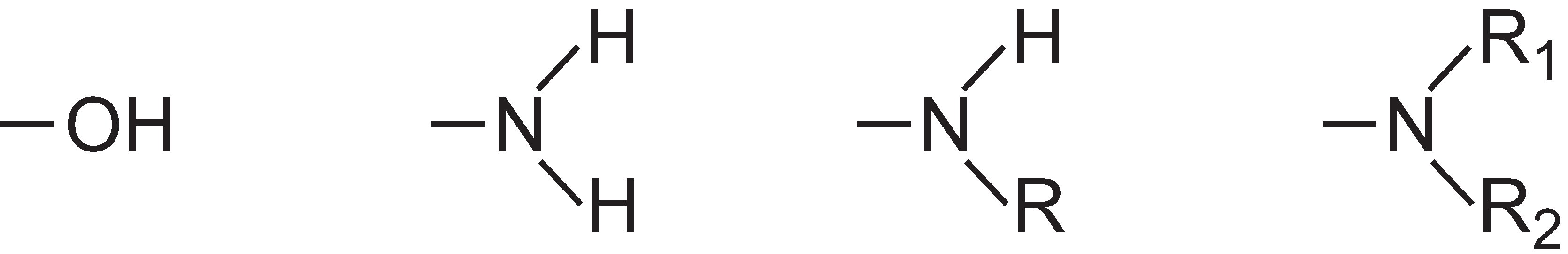
Estos grupos se conocen como auxocromos.
A veces, toda la estructura del colorante se denomina cromógeno.
Para que el colorante sea importante desde el punto de vista industrial, los químicos del color también deben ser capaces de alterar la solubilidad del compuesto, y se pueden incluir grupos para que el colorante sea soluble en agua. Algunos ejemplos son el grupo ácido sulfónico, -SO3H, o el grupo ácido carboxílico, -COOH, o más habitualmente, la sal sódica de estos ácidos, -SO3-Na+ y -COO-Na+, respectivamente.
Otra preocupación clave de los químicos que desarrollan colorantes es potenciar su reactividad con el objeto que quieren colorear, por ejemplo las moléculas de la fibra. Esto se discute a continuación y se dan ejemplos a lo largo de la unidad.
La coloración de los textiles
La naturaleza química de un colorante está determinada por las propiedades químicas y físicas de las fibras del textil a colorear. Los cuatro tipos principales de fibras (Tabla 1) son las proteicas, las celulósicas, las regeneradas (a base de celulosa o derivados) y las sintéticas.
| Fibras naturales | Fibras artificiales | ||
|---|---|---|---|
| Proteína | Celulosa | Regenerada | Sintética |
| Lana | Algodón | Rayón de viscosa | Poliamidas |
| Seda | Lino | Celulosa etanoatos | Poliésteres |
| Cabello | Ramio | Acrílicos | |
| Cachemira | |||
| El término regenerado se utiliza cuando un polímero natural ha sido tratado químicamente para formar otro polímero. Por ejemplo, la celulosa natural de las plantas, cuando se trata con anhídrido etanoico (anhídrido acético), produce un polímero, el etanoato de celulosa, que es el rayón. |
|||
Tabla 1 Clasificación de las fibras textiles.
Durante el proceso de teñido de un textil, el colorante se distribuye entre las dos fases, la fase de fibra sólida y la fase acuosa, y al final del proceso de teñido la solución se agota y la mayor parte del colorante se asocia a la fibra. Una vez que las moléculas de colorante penetran en la fibra, se produce una interacción inmediata entre los dos componentes, que impide la desorción de las moléculas de colorante hacia la solución. El tipo de interacción, ya sea física o química, dependerá de los grupos de las moléculas de colorante y de las cadenas de fibras (Tabla 2).
| Tipo de enlace | Fuerza relativa aproximada |
|---|---|
| covalente | 30,0 |
| iónico | 7.0 |
| hidrógeno | 3,0 |
| otros intermoleculares | 1,0 |
Tabla 2 Fortalezas relativas aproximadas de enlace entre un tinte y un tejido.

Figura 2 Antes de utilizar un colorante, se debe determinar su solidez a la luz. Estos
bastidores, situados en la costa noreste de Australia, se utilizan para muchas pruebas de
intemperie, entre ellas la solidez del color. La posición de los bastidores puede modificarse, pero en la foto, están en un ángulo de 45° con respecto a la horizontal.
Con la amable autorización del Laboratorio de Exposición de Allunga.
La solidez del color de un textil coloreado se define como su resistencia al cambio cuando se somete a una serie de condiciones particulares. El tinte no debe verse afectado en gran medida por la luz solar (solidez a la luz), el calor cuando se plancha el tejido (solidez al calor), la transpiración (solidez a la transpiración) y cuando se lava (solidez al lavado).
Clasificación de los colorantes
El Colour Index International, elaborado por la Society of Dyers and Colourists, en Bradford, es una lista exhaustiva de los tintes y pigmentos comerciales conocidos y se actualiza regularmente. A cada colorante se le asigna un nombre y un número de Colour Index (C.I.). Por ejemplo:
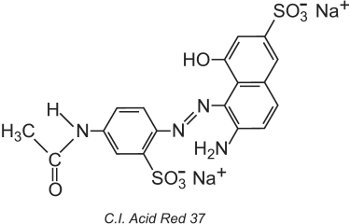
Todos los colorantes de la lista han sido clasificados por su estructura química y por su método de aplicación.
Clasificación de colorantes por su estructura química
El Colour Index asigna los colorantes de estructura conocida a una de las 25 clases estructurales según el tipo químico. Entre las más importantes se encuentran:
a) tintes azoicos
b) tintes de antraquinona
c) ftalocianinas
(a) Tintes azoicos
Los tintes azoicos constituyen la clase química más numerosa, ya que contienen al menos el 66% de todos los colorantes. El rasgo característico es la presencia en las estructuras de uno o más grupos azoicos,

junto con grupos hidroxilo, amina y grupos amina sustituidos como auxocromos.
Los compuestos azoicos aromáticos se producen a partir de aminas aromáticas a través de la correspondiente sal de diazonio.
Una sal de diazonio se forma cuando una amina aromática se trata con ácido nitroso (nítrico(III)). El ácido nitroso se forma in situ añadiendo ácido clorhídrico diluido a una solución fría de nitrito de sodio a unos 278 K. En el siguiente ejemplo, se ha formado una solución de cloruro de benzenediazonio a partir de fenilamina (anilina), la amina aromática más sencilla:

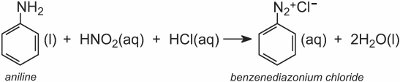
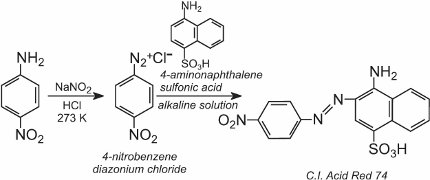
A continuación, se añade a la solución fría una solución de otro compuesto, como por ejemplo otra amina aromática o un fenol, que produce un compuesto azoico coloreado. Un ejemplo es la formación de un colorante rojo cuando se añade una solución acuosa de ácido 4-aminonaftalenosulfónico (ácido naftónico) a una solución de cloruro de 4-nitrobenzenediazonio para formar el C.I. Rojo ácido 74:
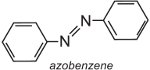
El azobenceno es el cromóforo de estos colorantes azoicos,
y se puede modificar el color de la molécula y aumentar la intensidad del color variando los auxocromos (Tabla 3).
| Estructura | Color observado |
|---|---|
 |
Amarillo-verde |
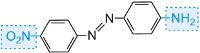 |
amarillo |
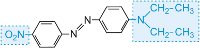 |
rojo |
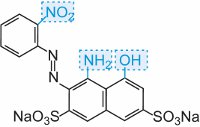 |
azul |
 |
Tabla 3 Las estructuras moleculares de algunos colorantes azoicos mostrando los auxocromos.
Algunos tintes azoicos, los que contienen un grupo hidroxi orto (o para) al grupo azo, por ejemplo, el Naranja Ácido C.I. 7, presentan tautomerismo, un proceso en el que la molécula existe como dos o más estructuras diferentes en equilibrio. El átomo de hidrógeno del grupo hidroxilo puede migrar al átomo de nitrógeno del grupo azo y viceversa:
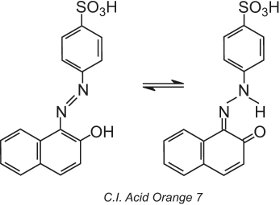
Este tipo de tautomerismo implica un equilibrio entre un tautómero de hidroxiazo y un tautómero de cetohidrazona, aunque generalmente domina el tautómero de cetohidrazona y el color observado es de mayor longitud de onda (un desplazamiento batocrómico).
(b) Tintes de antraquinona
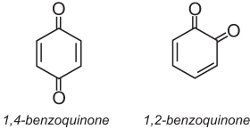
Los tintes de antraquinona representan alrededor del 15% de los colorantes y tienen estructuras basadas en quinonas. La quinona más simple es la benzoquinona, que tiene dos isómeros:
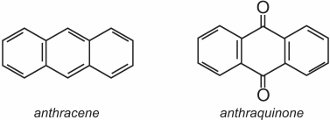
La antraquinona, la más simple de las antraquinonas, está basada en el antraceno:
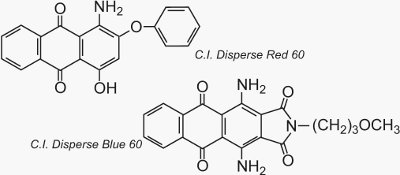
Dos ejemplos bien conocidos de antraquinonas que se utilizan como colorantes son C.I. Disperse Red 60 y C.I. Disperse Blue 60:
(c) Ftalocianinas
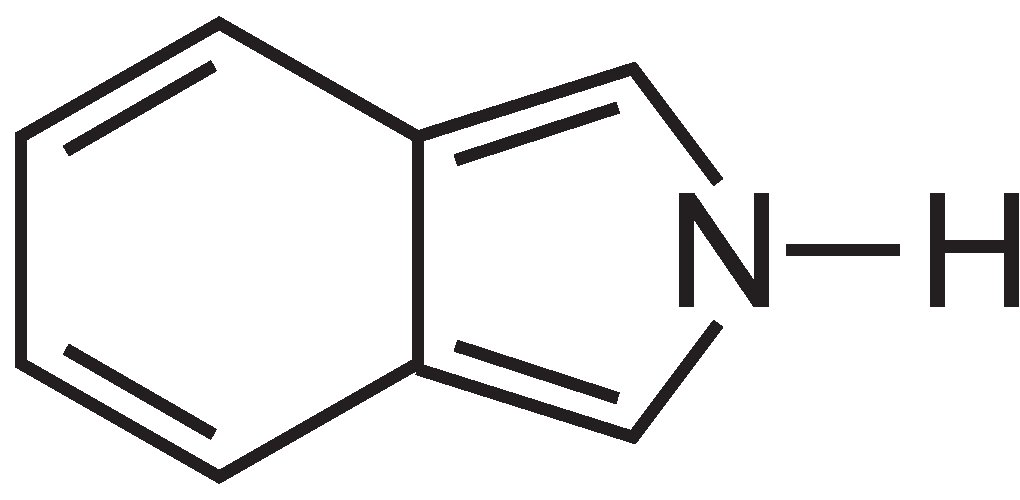
Las ftalocianinas están formadas esencialmente por cuatro moléculas de isoindol:
Estas moléculas están conectadas entre sí en una ftalocianina por átomos de nitrógeno. La estructura de la ftalocianina es:
Estas moléculas están conectadas entre sí en una ftalocianina por átomos de nitrógeno. La estructura de la ftalocianina es:
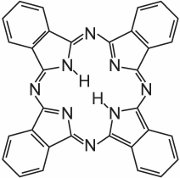
Las ftalocianinas se coordinan con átomos de metal. Las más importantes, que aportan alrededor del 2% de todos los colorantes, son las ftalocianinas de cobre, utilizadas por sus brillantes colores azul y verde. Un ejemplo es el C.I. Direct Blue 86:
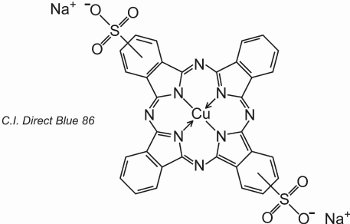
Los grupos de ácido sulfónico ayudan a la solubilidad del tinte en el agua.
La fórmula indica que los grupos de ácido sulfónico pueden estar en diferentes posiciones en los anillos aromáticos.
Clasificación de los colorantes por métodos de aplicación
La clasificación por el método de aplicación es importante para el tintorero textil que aplica el tinte para producir el color requerido. Para obtener el tono deseado, el tintorero suele tener que hacer mezclas de colorantes y debe asegurarse de que éstas sean compatibles.
Las características básicas que controlan la transferencia del tinte de la solución a la fibra son:
- el pH de la solución en el baño de tintura (para tintes ácidos y básicos)
- un electrolito (una solución de sulfato o cloruro de sodio)
- la temperatura (dentro del rango de ambiente a 400 K)
- productos químicos, conocidos como agentes dispersantes, que producen una dispersión acuosa estable de los colorantes de muy baja solubilidad
La tabla 4 enumera los colorantes bajo sus nombres tecnológicos que indican cómo se aplican, junto con las fibras a las que se aplican.
| Tinte | Fibra |
|---|---|
| Grupo 1 | |
| Ácido | Lana y otras fibras proteicas, poliamidas |
| Metal-complejo | Lana y otras fibras proteicas, poliamidas |
| Directas | Algodón, lino, viscosa |
| Básicas | Acrílicas |
| Dispersas | Poliésteres, poliamidas, etanoatos |
| Grupo 2 | |
| Reactivos | Algodón, lino, viscosa, lana, seda |
| IVA | Algodón, lino, viscosa |
| Azufre | Algodón, lino |
Tabla 4 Clasificación tecnológica de los tintes.
Colorantes del grupo 1
Los colorantes de este grupo se caracterizan por su solubilidad en el agua. En consecuencia, no son especialmente rápidos en el lavado. El método de aplicación implica un único proceso de una sola etapa.
(i) Colorantes ácidos
Los tipos químicos importantes son los azoicos, antraquinonas y ftalocianinas, que cubren todo el espectro visible y, por lo tanto, dan una gama completa de colores. Estos colorantes son solubles en agua dando especies aniónicas. Suelen aplicarse a unos 373 K. Mientras que la lana y otras fibras proteicas se degradan fácilmente por encima de esta temperatura, las fibras de poliamida (por ejemplo, los nylons) pueden tratarse a 393 K sin que sufran ningún daño (Tabla 4).
El pH elegido para la solución en el baño de tintura depende de las propiedades individuales de los tintes. Los valores más bajos se obtienen añadiendo ácido sulfúrico y los más altos añadiendo soluciones de ácido etanoico y sulfato de amonio o etanoato de amonio. Se puede añadir sulfato de sodio para controlar la difusión de los aniones del colorante en la estructura de la fibra.
Por la propia naturaleza de la estructura del colorante, se formarán enlaces iónicos, enlaces de hidrógeno y otras interacciones intermoleculares (Tabla 2) entre el colorante y la fibra, lo que hará que los colorantes sean rápidos. Un ejemplo de colorante ácido típico es el rojo ácido 73 de C.I.:
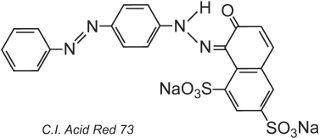
Uno de los grupos azoicos de este tautómero está presente en forma de cetohidrazona.
(ii) Colorantes de complejos metálicos
Los tipos químicos son azoicos y antraquinónicos, que ofrecen una gama completa de colores. Sin embargo, son más apagados que los tintes ácidos debido a la presencia de un átomo de metal en la estructura del tinte. A menudo se utilizan sales de cromo, aunque también se prefieren las de cobalto y níquel.
El átomo de metal forma un complejo de coordinación con dos moléculas de un compuesto monoazo que contiene grupos hidroxilo, carboxilo o amino en las posiciones 2,2′ respecto al grupo azo. Estos compuestos se denominan tintes «complejos metálicos 1:2». Un ejemplo es el C.I. Acid Violet 78:
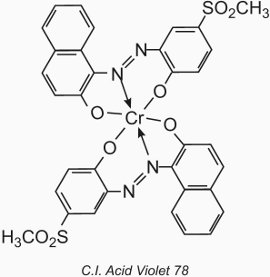
Su aplicación a la lana es similar a la de los colorantes ácidos, pero el valor del pH se limita al rango de 4,5 a 6,0 (Tabla 4).
(iii) Colorantes directos
Los colorantes directos son particularmente útiles para teñir fibras hechas de celulosa (Tablas 1 y 4).
Se sintetizan con grupos de ácido sulfónico para darles solubilidad en agua, disociándose para dar cationes de sodio y la especie de colorante aniónico. También se diseñan para que su estructura sea lo más lineal y plana posible. Esto permite que el colorante se adhiera a las cadenas celulósicas de la fibra, a menudo a través de enlaces intermoleculares (incluidos los de hidrógeno).
Se aplican en el baño de tintura en una solución acuosa que contiene cloruro de sodio. La sal reduce las fuerzas eléctricas de repulsión entre la carga negativa de la superficie de la fibra y la especie de colorante aniónico.
La mayoría de los colorantes directos son compuestos azoicos, que a menudo contienen dos o tres grupos azoicos. Entre los ejemplos se incluye el C.I. Direct Orange 25, que tiene grupos -OH, -NHCO- y -N=N, todos los cuales tienen el potencial de formar enlaces de hidrógeno con los grupos hidroxilos de la celulosa:
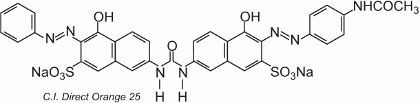
El colorante presenta tautomería, ya que hay dos grupos hidroxilos orto a los grupos azo. Uno de los tautómeros en equilibrio con esta forma es
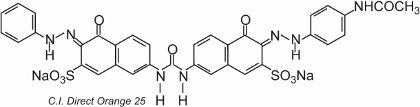
donde hay dos grupos cetohidrazona.
Otro ejemplo, el C.I. Direct Blue 71, tiene tres grupos azoicos, uno de los cuales está presente como tautómero de cetohidrazona:
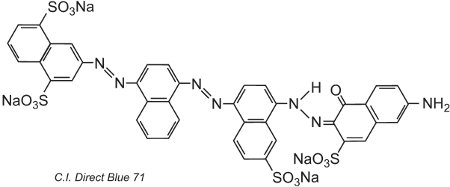
(iv) Tintes básicos
Los tintes básicos fueron de los primeros tintes sintéticos. De hecho, la malva es un tinte básico. El cromóforo está presente como catión y se utilizan hoy en día para teñir fibras acrílicas (normalmente un copolímero con propenonitrilo (acrilonitrilo) y una pequeña cantidad de un comonómero que contiene grupos sulfonato, -SO3-, y carboxilato, -CO2-). Se trata de interacciones iónicas (Tablas 2 y 4).
Existen unos 100 colorantes básicos (catiónicos) cuyos colores abarcan los rojos, amarillos y azules, con tonos fuertes y brillantes. Algunos se basan en los sistemas cromóforos azo y antraquinona. Muchos se basan también en iones de arilcarbono. Algunos ejemplos son el C.I. Basic Green 4 (conocido como verde malaquita) y el C.I. Basic Red 9.
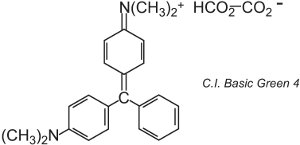 |
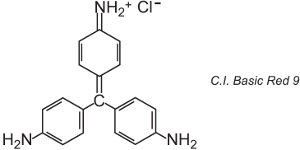 |
Ambos son triarilmetanos, un grupo de colorantes que con cambios relativamente pequeños en su estructura producen una gama de tonos rojos, verdes y violetas.
También se utilizan otros, conocidos como colorantes polimetanos (contienen uno o más grupos -CH=). Deben su color a la presencia de un sistema conjugado. Un ejemplo de este tipo de colorante es el C.I. Basic Yellow 28, que es una diazacianina:
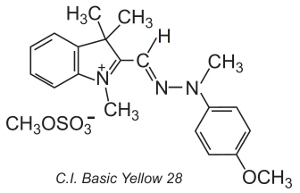
Los colorantes se aplican a menudo en una solución de un electrolito, que controla la velocidad de difusión en la estructura de la fibra, a temperaturas de unos 370 K.
(v) Colorantes dispersos
Estos colorantes son esencialmente hidrofóbicos y son casi insolubles en agua. Sin embargo, tienen afinidad por las fibras hidrofóbicas, por ejemplo los poliésteres, y se aplican como dispersiones muy finas en el agua (Tabla 4).
La mayoría de los colorantes dispersos son compuestos azoicos y pueden dar colores en todo el espectro. Algunos son tintes a base de antraquinona para rojos, violetas, azules y verdes.
Las fibras de poliéster pueden teñirse a 400 K bajo presión, lo que permite utilizar estructuras de tintes de mayor tamaño molecular que consiguen una mayor solidez, por ejemplo:
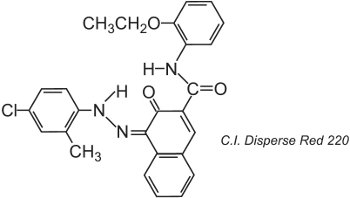
La estructura mostrada es el tautómero de la cetohidrazona.
Colorantes del grupo 2
Aunque los colorantes de este grupo se aplican mediante un proceso de dos etapas (que contrasta con el proceso de una sola etapa para los colorantes del grupo 1), los colorantes tienen ventajas, en particular con la solidez.
i) Colorantes reactivos
Los colorantes reactivos tienen una importancia destacada para la tintura del algodón, ya que permiten una coloración intensa y brillante con una alta solidez. Aproximadamente el 95% de los colorantes reactivos son colorantes azoicos que cubren toda la gama de colores. Los azules y los verdes también los proporcionan las estructuras de antraquinona y ftalocianina.
Como sugiere el nombre de estos colorantes, reaccionan con la fibra, ya sea celulósica (algodón) o proteica (lana) para formar enlaces covalentes (Tabla 4). Las dos etapas, primero el teñido y luego la reacción, pueden tener lugar por separado o simultáneamente. El rasgo estructural característico es la presencia de uno o más grupos reactivos. Normalmente los tintes se representan como
D-B-RG
donde D es el cromógeno, B un grupo puente y RG el grupo reactivo.
Los grupos reactivos más importantes son las triazinas cloradas y las vinilsulfonas.
Uno de los tres isómeros de la triazina más simple es:
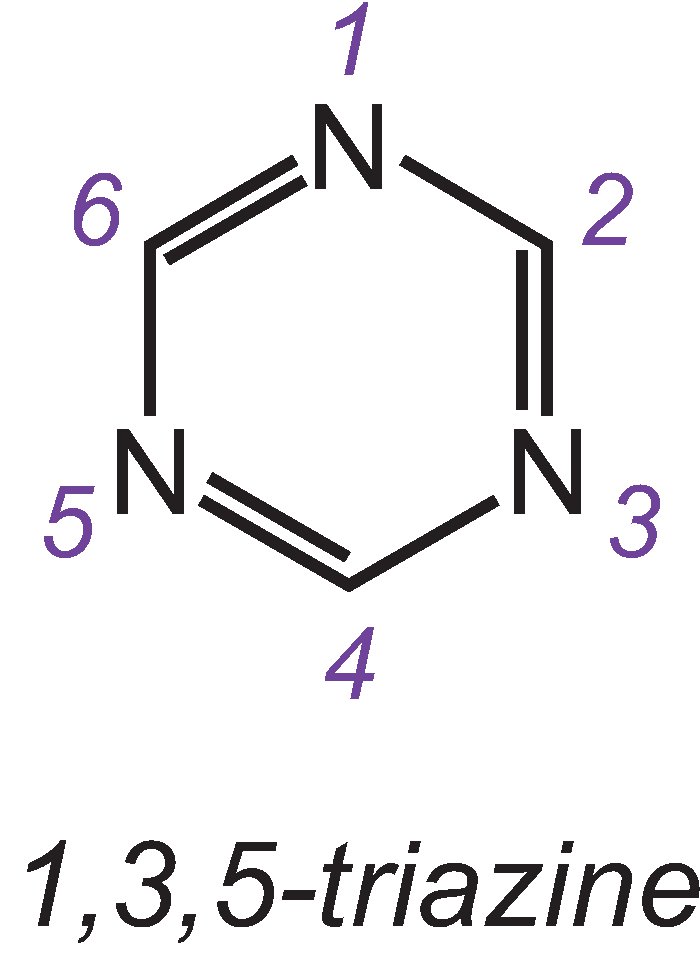
Un ejemplo de colorante con un grupo diclorotriazina es el C.I. Azul reactivo 109:
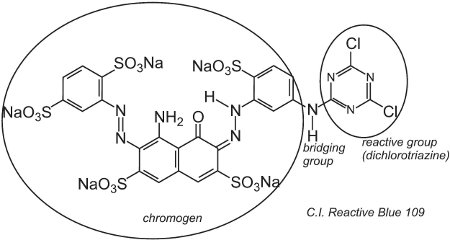
La reacción entre los grupos -OH de la celulosa de la fibra y los grupos -C-Cl de la clorotriazina se produce mediante una reacción de sustitución (nucleófila) para formar enlaces covalentes.
Una sulfona de etilo (vinilo) contiene el grupo CH2=CHSO2 y la más sencilla es la dietilsulfona (divinilsulfona). El grupo sulfona puede verse en el C.I. Reactive Blue 19:
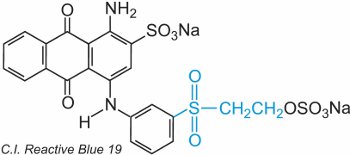
En este ejemplo, no hay grupo puente.
El colorante reacciona con la celulosa por adición al doble enlace azufre-oxígeno.
Los colorantes reactivos, en la solución acuosa, pueden sufrir la hidrólisis de la sulfona haciéndola no reactiva a la celulosa. Esto significa que el colorante sin reaccionar, si no se lava adecuadamente, permanecerá en la superficie del tejido dando un color aparente que se desvanecerá con el tiempo. Para reducir este problema, se han diseñado tintes con dos grupos reactivos de diferente reactividad. Estos tintes ofrecen una mayor solidez porque si uno de los grupos se hidroliza en la solución, el otro reacciona con los grupos hidroxilos del tejido. El primero de ellos incluye tanto un grupo clorotriazina como un grupo vinilsulfona y un ejemplo es el C.I. Reactive Red 194:
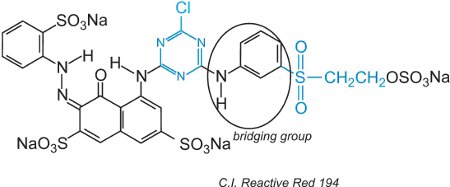
Además de los dos grupos reactivos diferentes, hay un cromógeno y un grupo puente.
Todos los tintes reactivos tienen un tamaño molecular relativamente pequeño y también tienen dos o más grupos de ácido sulfónico en el cromógeno, lo que conduce a una alta solubilidad en agua. Una parte de las especies de colorantes (aniónicos) no reacciona con la fibra y se hidroliza, y el producto debe eliminarse por lavado.

Figura 3 Los vaqueros se tiñen con índigo y con una variedad de colorantes sulfurosos, cuya elección depende del color deseado.
Con la amable autorización de Lizzie Hubbard.
(ii) Tintes de cuba
Aproximadamente el 80% de los tintes de cuba pertenecen a la clase química de las antraquinonas y cubren toda la gama de colores. Uno de los tipos, los tintes indigoides, incluye el índigo:
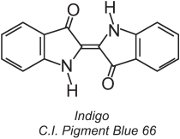
Todos los tintes de cuba son insolubles en agua. Para aplicarlos a una fibra, por ejemplo de algodón, se colocan en una solución alcalina (Tabla 4). El colorante insoluble se reduce para formar un anión incoloro (leuco) que es soluble y posee afinidad por la fibra. A continuación, la fibra lo adsorbe, a veces en presencia de cloruro de sodio, en condiciones similares a las de los colorantes directos. Después del proceso de teñido, el colorante original insoluble se regenera dentro de la fibra por oxidación, normalmente utilizando una solución de peróxido de hidrógeno o simplemente aire:
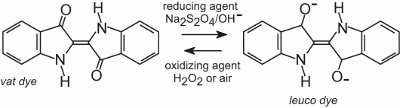
Los colorantes son insolubles dentro de la estructura de la fibra y, por tanto, tienen una buena solidez al lavado y también poseen una alta solidez a la luz.
(iii) Tintes de azufre
Los tintes de azufre, al igual que los tintes de cuba, se aplican a los textiles (celulosa, Tabla 4) como una forma aniónica soluble y luego se oxidan en la forma insoluble.
El negro de azufre C.I. 1 y el azul de azufre C.I. 7 se encuentran entre los tintes de azufre más utilizados. Al igual que otros tintes de azufre, sus estructuras son variables y en gran medida desconocidas. Proporcionan una gama de negros, marrones y azules apagados. Sin embargo, su producción es mucho más barata que la de los colorantes de cuba, ya que su preparación, mediante el calentamiento de diversos compuestos orgánicos con azufre, es sencilla.
Pigmentos
Los pigmentos se utilizan en la coloración de pinturas, tintas de impresión, cerámicas y plásticos. Pueden utilizarse en una variedad mucho más amplia de sustancias que los colorantes porque no dependen de la solubilidad en agua para su aplicación. Un pigmento es un sólido finamente dividido que es esencialmente insoluble en su medio de aplicación. En la mayoría de los casos, el pigmento se añade a un medio líquido, por ejemplo, pintura húmeda o un termoplástico fundido. A continuación, se deja que el medio se solidifique mediante la evaporación del disolvente o el enfriamiento, de modo que las moléculas del pigmento se fijan mecánicamente en el estado sólido.
Los cromóforos utilizados en los pigmentos suelen ser los mismos que los utilizados en los tintes, pero los pigmentos son moléculas grandes y no tienen grupos solubilizantes. Contienen grupos que forman enlaces intermoleculares que ayudan a reducir las solubilidades. Cuanto más grande es la molécula, más opaco es el pigmento.

| Figuras 4 y 5 Los colorantes rojos y amarillos son pigmentos azoicos (C.I. Pigmento Rojo 57 y C.I. Pigmento Amarillo 13). El azul es el pigmento ftalocianina de cobre. Con la amable autorización de BASF. |
 |
Los pigmentos orgánicos suelen producir una mayor intensidad y brillo de color que los pigmentos inorgánicos, como el amarillo de cromo (cromato de plomo (II) (VI)).
Los pigmentos orgánicos presentan una serie de propiedades de solidez que dependen de la estructura molecular y de la naturaleza de la asociación intramolecular en el estado sólido. El aumento del tamaño molecular de un pigmento suele disminuir su solubilidad. Además, muchos pigmentos llevan incorporado el grupo amida (-NHCO-), lo que disminuye aún más su solubilidad, ya que las moléculas se mantienen unidas en grandes estructuras por enlaces de hidrógeno (entre el grupo N-H de una molécula y un grupo C=O de otra).
Muchos pigmentos orgánicos se basan en la química azoica y dominan las zonas de tonos amarillos, naranjas y rojos. Un ejemplo de pigmento monoazo simple es el C.I. Pigment Yellow 1:
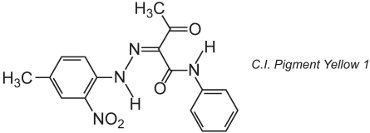
Esta forma es el tautómero de la cetohidrazona.
Las ftalocianinas de cobre proporcionan la mayoría de los pigmentos azules y verdes. Son estructuralmente complejas pero su fabricación es relativamente barata. Proporcionan una excelente resistencia a la luz, al calor, a los ácidos y a los álcalis.
Un ejemplo es el C.I. Pigment Blue 15:
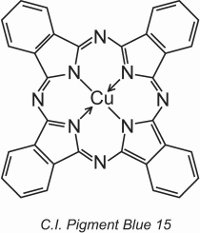
Al principio de la unidad, se mostró la estructura de un tinte, el C.I. Direct Blue 86, y se puede ver cómo los grupos de ácido sulfónico de esa estructura transforman un pigmento en un tinte.
Colores y pigmentos funcionales (de alta tecnología)
Los tintes y pigmentos funcionales se producen en pequeños volúmenes en comparación con los compuestos utilizados para teñir textiles. Sin embargo, son objeto de mucha investigación e interés y se están desarrollando para diversos fines. Algunos de ellos se ilustran a continuación.
(a) Pantallas de cristal líquido
Los cristales líquidos han desempeñado un papel importante en nuestras vidas durante muchos años en diversas formas de pantallas de información, por ejemplo, las calculadoras. Al principio sólo podían mostrar las diferencias entre la luz y la oscuridad. Se descubrió que utilizando tintes se podía aumentar el contraste y producir pantallas de colores. En la actualidad han sustituido en gran medida a las tecnologías tradicionales de visualización de diodos emisores de luz y tubos de rayos catódicos. Los colorantes utilizados se han diseñado específicamente para cambiar de orientación con las moléculas de cristal líquido y, por tanto, ofrecen una mayor intensidad de color. Se dice que estos tintes presentan dicroísmo.
(b) Tintes láser
El término láser es un acrónimo que se refiere a la amplificación de la luz por emisión estimulada de radiación.
Comúnmente se utilizaban láseres inorgánicos pero sólo tenían la capacidad de producir radiación en unas pocas longitudes de onda seleccionadas y en bandas muy estrechas. El uso de colorantes ha permitido la producción de luz en todo el espectro, desde longitudes de onda de 320 a 1200 nm. Las aplicaciones de los láseres de colorante incluyen la tecnología de la comunicación y la microcirugía.
(c) Impresión por chorro de tinta
La impresión por chorro de tinta es una técnica sin impacto para producir imágenes dirigiendo pequeñas gotas de tinta, idealmente bajo control informático, en rápida sucesión sobre un sustrato. Ha encontrado muchas aplicaciones. Debido a los requisitos de tamaño de las gotas para conseguir una buena definición, se ha favorecido el uso de colorantes en lugar de pigmentos. Las gotas son más pequeñas (los pigmentos tienden a bloquear las boquillas) y la solubilidad acuosa reduce el impacto medioambiental y mantiene el precio bajo. Los primeros tintes eran los que ya se utilizaban en otras industrias, pero se caracterizaban por su escasa resistencia al agua. Esto ha llevado al desarrollo de tintes específicos y sistemas de fluidos únicos. Estos tintes están diseñados para ser solubles en sistemas ligeramente alcalinos (pH 7,5 a 10) que se vuelven insolubles por las condiciones ligeramente ácidas (pH 4,5 a 6,5) del papel u otro sustrato. Esta tecnología está teniendo un gran impacto en la impresión industrial de gran volumen para envases, textiles, revestimientos de paredes y expositores publicitarios.
(d) Terapia fotodinámica
Se trata de un tratamiento para el cáncer que utiliza una combinación de luz láser, un compuesto fotosensibilizador (el tinte) y oxígeno molecular. El tinte se administra al paciente por vía intravenosa y con el tiempo entra en las células cancerosas. La irradiación de las células con luz láser puede iniciar su destrucción.
El láser interactúa con el colorante y lo promueve a su estado excitado. A través de un complejo proceso, se producen moléculas de oxígeno excitadas (más reactivas) que reaccionan con los centros insaturados de las proteínas y los lípidos de la membrana celular. Este método de tratamiento evita el uso de la cirugía invasiva.