Oppimistavoitteet
- Erittele, miksi alkoholien kiehumispisteet ovat korkeammat kuin vastaavien moolimassaltaan samankaltaisten eetterien ja alkaanien kiehumispisteet.
- Erittele, miksi alkoholit ja eetterit, joissa on enintään neljä hiiliatomia, liukenevat veteen, kun taas vertailukelpoiset alkaanit eivät liukene.
Alkoholeja voidaan pitää veden (H2O; kirjoitetaan myös HOH) johdannaisina.

Veden H-O-H-sidoksen tavoin R-O-H-sidos on taipunut, ja alkoholimolekyylit ovat poolisia. Tämä suhde näkyy erityisesti pienissä molekyyleissä ja heijastuu pienen moolimassan omaavien alkoholien fysikaalisiin ja kemiallisiin ominaisuuksiin. Alkaanin vetyatomin korvaaminen OH-ryhmällä antaa molekyyleille mahdollisuuden liittyä toisiinsa vetysidoksen avulla (kuva \(\PageIndex{1}\)).
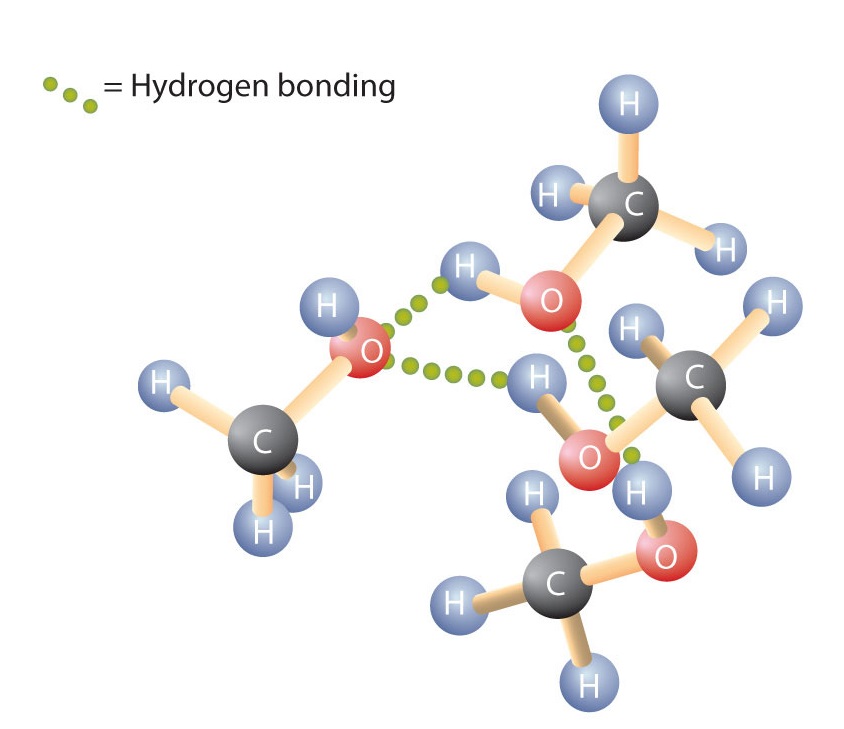
muistetaan, että fysikaaliset ominaisuudet määräytyvät suurelta osin sen mukaan, millaisia molekyylien väliset voimat ovat. Taulukossa \(\PageIndex{1}\) luetellaan joidenkin yleisten yhdisteiden moolimassat ja kiehumispisteet. Taulukosta käy ilmi, että aineilla, joiden moolimassa on samankaltainen, voi olla varsin erilaiset kiehumispisteet.
| Formula | Nimi | Moolimassa | Kiehumispiste (°C) |
|---|---|---|---|
| CH4 | metaani | 16 | -164 |
| HOH | vesi | 18 | 100 |
| C2H6 | etaani | 30 | -89 |
| CH3OH | metanoli | 32 | 65 |
| C3H8 | propaani | 44 | -42 |
| CH3CH2OH | etanoli | 46 | 78 |
| C4H10 | butaani | 58 | -1 |
| CH3CH3CH2CH2OH | |||
| C4H10 | C4H10 | Butan | 58 |
| 60 | 97 |
Alkaanit ovat poolittomia ja liittyvät siten toisiinsa vain suhteellisen heikkojen dispersiovoimien kautta. Alkaanit, joissa on yhdestä neljään hiiliatomia, ovat kaasuja huoneenlämmössä. Sitä vastoin jopa metanoli (jossa on yksi hiiliatomi) on huoneenlämmössä neste. Vetysidokset nostavat huomattavasti alkoholien kiehumispisteitä verrattuna vastaavan moolimassan omaaviin hiilivetyihin. Kiehumispiste on karkea mittari sille, kuinka paljon energiaa tarvitaan nestemäisen molekyylin erottamiseen lähimmistä naapureistaan. Jos molekyylit ovat vuorovaikutuksessa vetysidoksen välityksellä, näiden molekyylien välisten vetovoimien katkaisemiseen tarvitaan suhteellisen suuri määrä energiaa. Vasta silloin molekyyli voi siirtyä nesteestä kaasumaiseen tilaan.
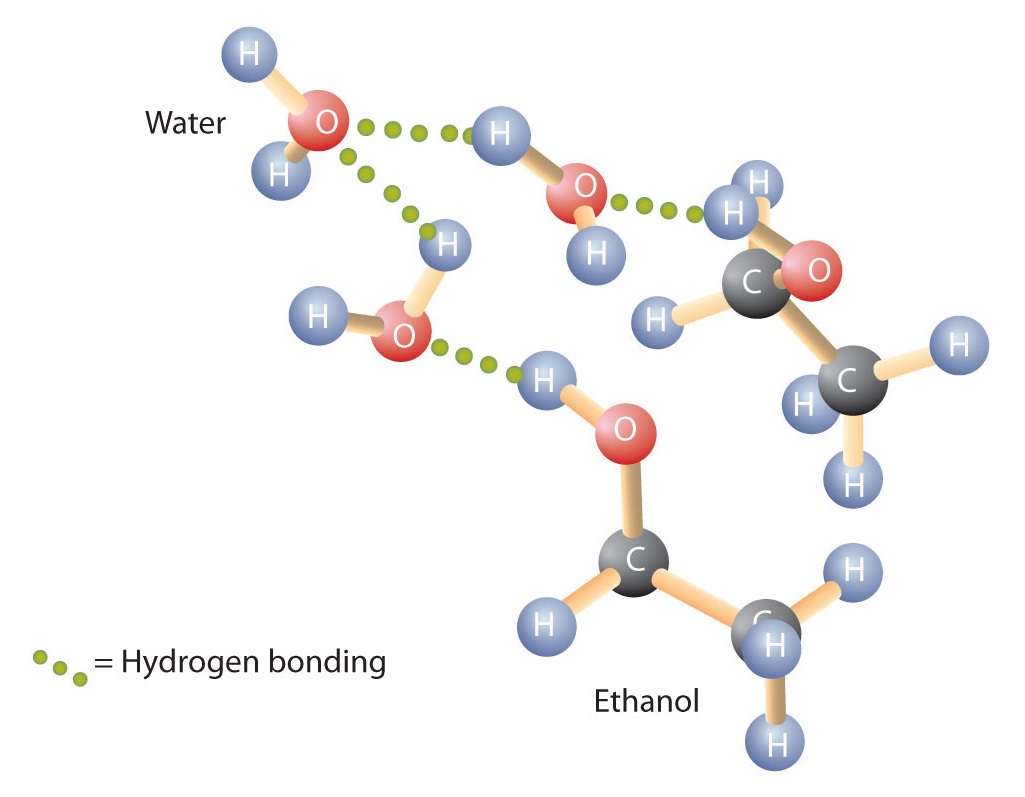
Alkoholit voivat myös sitoutua vetysidokseen vesimolekyylien kanssa (kuva \(\PageIndex{2}\)). Näin ollen hiilivedyt ovat veteen liukenemattomia, kun taas alkoholit, joissa on yhdestä kolmeen hiiliatomia, ovat täysin liukoisia. Ketjun pituuden kasvaessa alkoholien liukoisuus veteen kuitenkin vähenee; molekyylit muistuttavat enemmän hiilivetyjä ja vähemmän vettä. Alkoholi 1-dekanoli (CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2OH) on olennaisesti liukenematon veteen. Huomaamme usein, että liukoisuuden raja orgaanisten yhdisteiden perheessä kulkee neljän tai viiden hiiliatomin kohdalla.
Yhteenveto
Alkoholien kiehumispisteet ovat korkeammat kuin samankaltaisten moolimassojen eettereillä ja alkaaneilla, koska OH-ryhmä sallii alkoholimolekyylien sitoutua vetysidoksiin. Alkoholit, joissa on neljä tai vähemmän hiiliatomeja, liukenevat veteen, koska alkoholimolekyylit sitoutuvat vetysidokseen vesimolekyylien kanssa; vertailukelpoiset alkaanimolekyylit eivät voi sitoutua vetysidokseen.
Käsitteiden kertausharjoitukset
-
Miksi etanoli liukenee veteen paremmin kuin 1-heksanoli?
-
Miksi 1-butanolin kiehumispiste on alempi kuin 1-heksanolin?
Vastaukset
-
Etanolissa on OH-ryhmä ja vain 2 hiiliatomia; 1-heksanolissa on yksi OH-ryhmä 6:ta hiiliatomia kohden ja se on siten enemmän (poolittoman) hiilivedyn kaltainen kuin etanoli.
-
1-heksanolin moolimassa on suurempi kuin 1-butanolin.
Harjoitukset
Vastaat seuraaviin tehtäviin tutustumatta tekstissä oleviin taulukoihin.
-
Järjestä nämä alkoholit kiehumispisteen mukaisessa järjestyksessä: etanoli, metanoli ja 1-propanoli.
-
Kummalla on korkeampi kiehumispiste – butaanilla vai 1-propanolilla?
-
JÄRJESTÄKÄÄ nämä alkoholit kasvavaan järjestykseen liukoisuuden mukaan veteen: 1- butanoli, metanoli ja 1-oktanoli.
-
Järjestä nämä yhdisteet kasvavaan vesiliukoisuusjärjestykseen: 1-butanoli, etanoli ja pentaani.
Vastaukset
-
metanoli < etanoli < 1-propanoli
-
1-oktanoli < 1-butanoli < metanoli