Oppimistavoitteet
- Tietää hapon tai emäksen vahvuuden ja \(K_a\), \(K_b\), \(pK_a\), \(pK_a\) ja \(pK_b\) suuruuden välinen suhde.
- Ymmärtää tasoitusvaikutuksen.
Ionisaatioreaktion tasapainovakion suuruutta voidaan käyttää happojen ja emästen suhteellisten vahvuuksien määrittämiseen. Esimerkiksi heikon hapon ionisaation yleinen yhtälö vedessä, jossa HA on emähappo ja A- sen konjugaattiemäs, on seuraava:
\
Tämän dissosiaation tasapainovakio on seuraava:
\}{} \label{16.5.2}\]
Kuten aiemmin totesimme, veden konsentraatio on olennaisesti vakio kaikissa vesiliuoksessa tapahtuvissa reaktioissa, joten \(\) yhtälössä \(\ref{16.5.2}\) voidaan sisällyttää uuteen suureeseen, hapon ionisaatiovakioon (\(K_a\)), jota kutsutaan myös hapon dissosiaatioyhtälöksi:
\= \dfrac{}}{} \label{16.5.3}\]
Siten K:n ja \(K_a\) numeeriset arvot eroavat toisistaan veden konsentraation (55,3 M) mukaan. Jälleen yksinkertaisuuden vuoksi \(H_3O^+\) voidaan kirjoittaa \(H^+\) yhtälössä \(\ref{16.5.3}\). Muista kuitenkin, että vapaata \(H^+\) ei ole vesiliuoksissa ja että kaikissa happoionisaatioreaktioissa protonia siirretään \(H_2O\):lle, jolloin muodostuu hydroniumioneja, \(H_3O^+\). Mitä suurempi \(K_a\) on, sitä vahvempi happo on ja sitä suurempi on \(H^+\)-pitoisuus tasapainotilassa. Kuten kaikki tasapainovakiot, happo-emäs-ionisaatiovakiot mitataan itse asiassa \(H^+\) tai \(OH^-\) aktiivisuutena, joten ne ovat yksiköimättömiä. Taulukossa \(\PageIndex{1}\) on esitetty \(K_a\)-arvot useille yleisille hapoille.
Heikot emäkset reagoivat veden kanssa tuottaen hydroksidi-ionin, kuten seuraavasta yleisestä yhtälöstä käy ilmi, jossa B on emäs ja BH+ on sen konjugaattihappo:
\
Tämän reaktion tasapainovakio on emäksen ionisaatiovakio (Kb), jota kutsutaan myös emäksen dissosiaatio- eli hajoamisvakioksi:
\= \frak{}{}{} \label{16.5.5}\]
Jälleen kerran veden konsentraatio on vakio, joten se ei näy tasapainovakion lausekkeessa, vaan se sisältyy \(K_b\). Mitä suurempi \(K_b\) on, sitä vahvempi on emäs ja sitä suurempi on \(OH^-\)-pitoisuus tasapainotilassa. Taulukossa \(\PageIndex{2}\) on esitetty \(K_b\) arvot useille tavallisille heikoille emäksille.
Hapon \(K_a\) suuruuden ja sen konjugaattiemäksen \(K_b\) välillä on yksinkertainen suhde. Tarkastellaan esimerkiksi syaanivetyhapon (\(HCN\)) ionisaatiota vedessä happaman liuoksen tuottamiseksi ja \(CN^-\) reaktiota veden kanssa emäksisen liuoksen tuottamiseksi:
\
\
Tasapainovakion lauseke HCN:n ionisoitumiselle on seuraavanlainen:
\}{} \label{16.5.8}\]
Vastaava lauseke syanidin reaktiolle veden kanssa on seuraava:
\}{} \label{16.5.9}\]
Jos lisätään yhtälöt \(\ref{16.5.6}\) ja \(\ref{16.5.7}\\), saamme seuraavat:
| Reaktio | Tasapainovakiot |
|---|---|
| \(\cancel{HCN_{(aq)}} \rightleftharpoons H^+_{(aq)}+\cancel{CN^-_{(aq)}} \) | \(K_a=\cancel{}/\cancel{}\) |
| \(\cancel{CN^-_{(aq)}}+H_2O_{(l)} \rightleftharpoons OH^-_{(aq)}+\cancel{HCN_{(aq)}}\) | \(K_b=\cancel{}/\cancel{}\) |
| \(H_2O_{(l)} \rightleftharpoons H^+_{(aq)}+OH^-_{(aq)}\) | \(K=K_a \times K_b=\) |
Tässä tapauksessa, \(K_a\) ja \(K_b\) kuvaamien reaktioiden summa on veden autoionisaation yhtälö, ja näiden kahden tasapainovakion tulo on \(K_w\):
Aivan kuten \(pH\), \(pOH\) ja pKw:n kohdalla, voimme käyttää negatiivisia logaritmeja välttyäksemme eksponenttimerkinnöiltä happojen ja emästen ionisaatiovakioiden kirjoittamisessa määrittelemällä \(pK_a\) seuraavasti:
\
\
ja \(pK_b\) seuraavasti:
\
Vastaavasti yhtälö \(\ref{16.5.10}\\), joka ilmaisee \(K_a\) ja \(K_b\) välisen suhteen, voidaan kirjoittaa logaritmisessa muodossa seuraavasti:
\
25 °C:n lämpötilassa tästä tulee
\
Taulukoissa \(pK_a\) ja \(pK_b\) on esitetty useiden yleisten happojen ja emästen arvot taulukoissa \(\PageIndex{1}\) ja \(\PageIndex{2}\), ja laajemmat tiedot esitetään taulukoissa E1 ja E2. Negatiivisten logaritmien käytön vuoksi \(pK_a\) pienemmät arvot vastaavat suurempia happojen ionisaatiovakioita ja siten vahvempia happoja. Esimerkiksi typpihappo (\(HNO_2\)), jonka \(pK_a\) on 3,25, on noin miljoona kertaa vahvempi happo kuin syaanivetyhappo (HCN), jonka \(pK_a\) on 9,21. Vastaavasti pienemmät \(pK_b\)-arvot vastaavat suurempia emäksen ionisaatiovakioita ja siten vahvempia emäksiä.
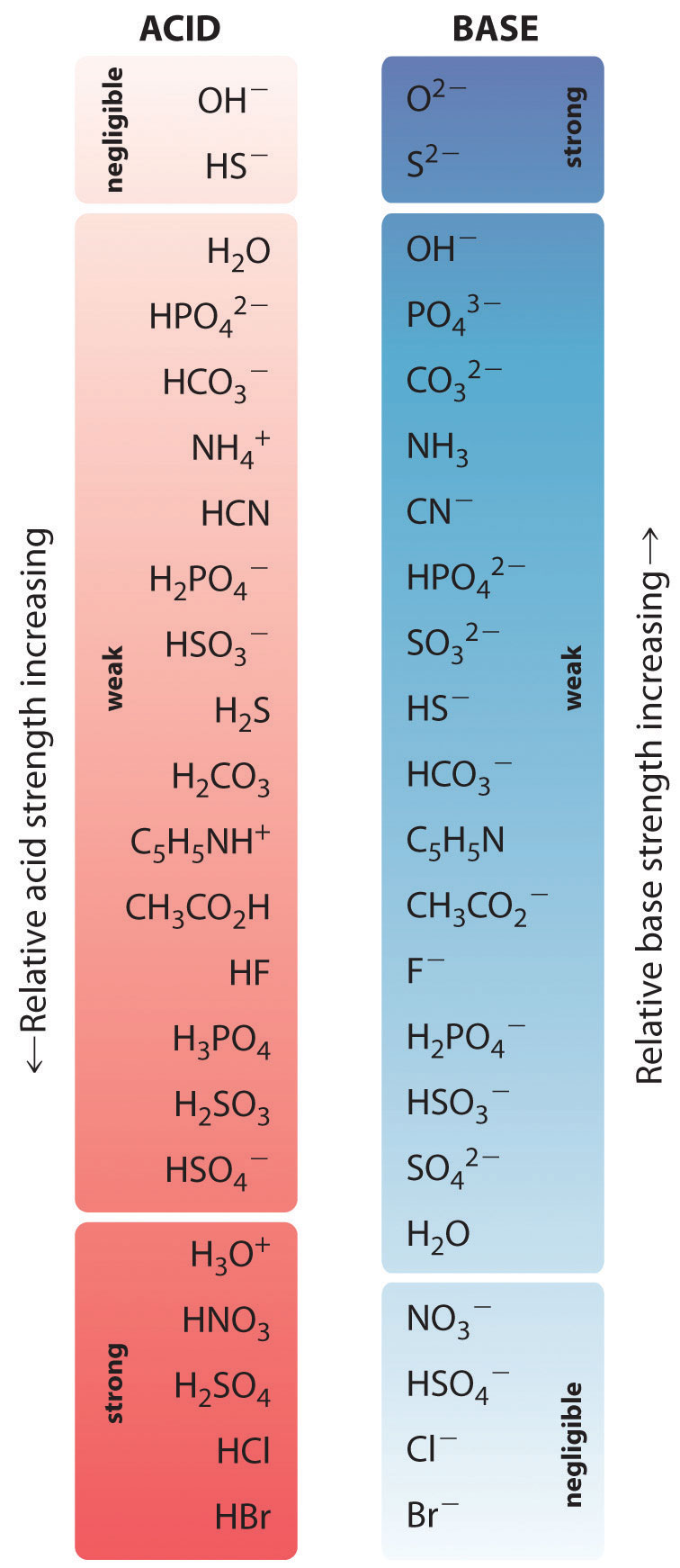
Joidenkin yleisten happojen ja niiden konjugaattiemästen suhteelliset vahvuudet on esitetty graafisesti kuvassa \(\PageIndex{1}\). Konjugoituneet happo-emäsparit on lueteltu (ylhäältä alaspäin) hapon voimakkuuden lisääntymisjärjestyksessä, joka vastaa \(pK_a\):n pieneneviä arvoja. Tämä järjestys vastaa konjugaattiemäksen voimakkuuden vähenemistä tai \(pK_b\):n kasvavia arvoja. Kuvion \(\PageIndex{2}\) vasemmassa alareunassa ovat yleisimmät vahvat hapot; oikeassa yläreunassa ovat yleisimmät vahvat emäkset. Huomaa käänteinen suhde emähapon vahvuuden ja konjugaattiemäksen vahvuuden välillä. Siten vahvan hapon konjugaattiemäs on hyvin heikko emäs, ja hyvin heikon hapon konjugaattiemäs on vahva emäs.
Vahvan hapon konjugaattiemäs on heikko emäs ja päinvastoin.
Happojen ja emästen suhteellisten vahvuuksien avulla voimme ennustaa happo-emäsreaktion suunnan noudattamalla yhtä sääntöä: happo-emästasapaino suosii aina sitä puolta, jolla on heikompi happo ja emäs, kuten nämä nuolet osoittavat:
\
Happo-emäsreaktiossa protoni reagoi aina vahvemman emäksen kanssa.
Esimerkiksi suolahappo on vahva happo, joka ionisoituu laimeassa vesiliuoksessa olennaisesti kokonaan muodostaen \(H_3O^+\) ja \(Cl^-\); vain häviävän pieni määrä \(HCl\)-molekyylejä jää dissosioitumatta. Näin ollen ionisaatiotasapaino on käytännössä kokonaan oikealla, kuten yksi nuoli esittää:
\\
Eetikkahappo on sitä vastoin heikko happo ja vesi on heikko emäs. Näin ollen etikkahapon vesiliuokset sisältävät enimmäkseen etikkahappomolekyylejä tasapainossa pienen \(H_3O^+\)- ja asetaatti-ionikonsentraation kanssa, ja ionisaatiotasapaino on kaukana vasemmalla, kuten nämä nuolet esittävät:
\\
Vastaavasti ammoniakin reaktiossa veden kanssa hydroksidi-ioni on vahva emäs ja ammoniakki on heikko emäs, kun taas ammoniumioni on vettä vahvempi happo. Näin ollen tämäkin tasapaino on vasemmalla:
\
Kaikki happo-emästasapainot suosivat sitä puolta, jolla on heikompi happo ja emäs. Protonit sitoutuvat siis vahvempaan emäkseen.
Esimerkki \(\PageIndex{1}\): Butyraatti- ja dimetyyliammoniumionit
- Lasketaan butyraatti-ionin (\(CH_3CH_2CH_2CO_2^-\)) \(K_b\) ja \(pK_b\). Viinihapon \(pK_a\) 25 °C:ssa on 4,83. Butyyrihappo aiheuttaa härskiintyneen voin pahan hajun.
- Laskekaa dimetyyliammoniumionin (\((CH_3)_2NH_2^+\)) \(K_a\) ja \(pK_a\). Dimetyyliamiinin (\((CH_3)_2NH\)) emäksinen ionisaatiovakio \(K_b\)) on \(5.4 \ kertaa 10^{-4}\) 25°C:ssa.
Anna: \(pK_a\) ja \(K_b\)
Kysytään: vastaavat \(K_b\) ja \(pK_b\), \(K_a\) ja \(pK_a\)
Strategia:
Vakiot \(K_a\) ja \(K_b\) liittyvät toisiinsa yhtälön \(\ref{16.5.10}\). Hapon ja sen konjugaattiemäksen \(pK_a\) ja \(pK_b\) liittyvät toisiinsa yhtälöiden \(\ref{16.5.15}\) ja \(\ref{16.5.16}\) mukaisesti. Käytä suhteita pK = -log K ja K = 10-pK (yhtälöt \(\ref{16.5.11}\) ja \(\ref{16.5.13}\)) muunnettaessa \(K_a\) ja \(pK_a\) tai \(K_b\) ja \(pK_b\).
Ratkaisu:
Meille annetaan voihapon \(pK_a\) ja pyydetään laskemaan \(K_b\) ja \(pK_b\) sen konjugaattiemäkselle, butyraatti-ionille. Koska mainittu \(pK_a\)-arvo koskee 25 °C:n lämpötilaa, voimme käyttää yhtälöä \(\ref{16.5.16}\): \(pK_a\) + \(pK_b\) = pKw = 14,00. Korvaamalla \(pK_a\) ja ratkaisemalla \(pK_b\),
\
\
Koska \(pK_b = -\log K_b\), \(K_b\) on \(10^{-9.17} = 6.8 \ kertaa 10^{-10}\).
Tässä tapauksessa meille annetaan \(K_b\) emäkselle (dimetyyliamiini) ja pyydetään laskemaan \(K_a\) ja \(pK_a\) sen konjugaattihapolle, dimetyyliammoniumionille. Koska annettu alkusumma on \(K_b\) eikä \(pK_b\), voimme käyttää yhtälöä \(\ref{16.5.10}\): \(K_aK_b = K_w\). Korvaamalla \(K_b\) ja \(K_w\) arvot 25 °C:ssa ja ratkaisemalla \(K_a\),
\
\
Koska \(pK_a\) = -log \(K_a\), saadaan \(pK_a = -\log(1.9 \ kertaa 10^{-11}) = 10.72\). Olisimme myös voineet muuntaa \(K_b\) \(pK_b\):ksi saadaksemme saman vastauksen:
\
\
\
\
Jos meille annetaan jokin näistä neljästä hapon tai emäksen suureesta (\(K_a\), \(pK_a\), \(K_b\) tai \(pK_b\)), voimme laskea kolme muuta.
Harjoitus \(\PageIndex{1}\): Maitohappo
Maitohappo (\(CH_3CH(OH)CO_2H\)) on vastuussa happaman maidon pistävästä mausta ja hajusta; sen ajatellaan myös aiheuttavan arkuutta väsyneissä lihaksissa. Sen \(pK_a\) on 3,86 25 °C:ssa. Laske maitohapon \(K_a\) ja laktaatti-ionin \(pK_b\) ja \(K_b\).
Vastaus
- \(K_a = 1,4 \ kertaa 10^{-4}\) maitohapolle;
- \(pK_b\) = 10.14 ja
- \(K_b = 7.2 \times 10^{-11}\) laktaatti-ionille
Solutions of Strong Acids and Bases: The Leveling Effect
Taulukosta \(\PageIndex{1}\) huomaat, että hapot, kuten \(H_2SO_4\) ja \(HNO_3\), sijaitsevat hydronium-ionin yläpuolella, mikä tarkoittaa, että niiden \(pK_a\)-arvot ovat pienempiä kuin nolla ja että ne ovat vahvempia happoja kuin \(H_3O^+\)-ioni. Muistetaan luvusta 4, että käytännössä kaikkien oksohappojen hapan protoni on sitoutunut yhteen oksoanionin happiatomeista. Typpihappo pitäisi siis kirjoittaa \(HONO_2\). Valitettavasti oksohappojen kaavat kirjoitetaan kuitenkin lähes aina niin, että vety on vasemmalla ja happi oikealla, jolloin saadaan \(HNO_3\). Itse asiassa kaikilla kuudella yleisellä vahvalla hapolla, joihin törmäsimme ensimmäisen kerran luvussa 4, on \(pK_a\)-arvot alle nollan, mikä tarkoittaa, että niillä on suurempi taipumus menettää protoni kuin \(H_3O^+\)-ionilla. Sitä vastoin näiden vahvojen happojen konjugaattiemäkset ovat vettä heikompia emäksiä. Näin ollen näiden vahvojen happojen protoninsiirtotasapainot ovat kaukana oikealla, ja minkä tahansa tavallisen vahvan hapon lisääminen veteen johtaa olennaisesti stoikiometriseen hapon ja veden väliseen reaktioon, jossa muodostuu \(H_3O^+\)-ionin ja hapon konjugaattiemäksen liuos.
Vaikka \(HI\):n \(K_a\) on noin 108 suurempi kuin \(HNO_3\):n \(K_a\), joko \(HI\):n tai \(HNO_3\):n reaktio veden kanssa antaa olennaisesti stoikiometrisen liuoksen \(H_3O^+\):sta ja I-:stä tai \(NO_3^-\):sta. Itse asiassa minkä tahansa vahvan hapon 0,1 M vesiliuos sisältää itse asiassa 0,1 M \(H_3O^+\) riippumatta vahvan hapon identiteetistä. Tätä ilmiötä kutsutaan tasausilmiöksi: mikä tahansa laji, joka on vahvempi happo kuin veden konjugaattihappo (\(H_3O^+\)), tasaantuu \(H_3O^+\):n vahvuuteen vesiliuoksessa, koska \(H_3O^+\) on vahvin happo, joka voi olla tasapainossa veden kanssa. Näin ollen HI:n ja HNO3:n kaltaisten happojen vahvuuksia vesiliuoksessa on mahdotonta erottaa toisistaan, ja niiden suhteellisten happovahvuuksien määrittämiseksi on käytettävä vaihtoehtoista lähestymistapaa.
Yksi menetelmä on käyttää liuotinta, kuten vedetöntä etikkahappoa. Koska etikkahappo on vettä vahvempi happo, sen on oltava myös heikompi emäs, jolla on pienempi taipumus ottaa protoni kuin \(H_2O\). Sekä HI:n että \(HNO_3\):n 0,1 M:n liuosten johtokyvyn mittaukset etikkahapossa osoittavat, että HI on täysin dissosioitunut, mutta \(HNO_3\) on vain osittain dissosioitunut ja käyttäytyy tässä liuottimessa heikon hapon tavoin. Tämä tulos kertoo selvästi, että HI on vahvempi happo kuin \(HNO_3\). Taulukon \(\PageIndex{1}\) yläosassa olevien vahvojen happojen happovahvuuksien suhteellinen järjestys ja likimääräiset \(K_a\)- ja \(pK_a\)-arvot määritettiin tämänkaltaisten mittausten ja eri ei-vesiliuottimien avulla.
Vesiliuoksissa \(H_3O^+\) on vahvin happo ja \(OH^-\) on vahvin emäs, joka voi olla tasapainossa \(H_2O\):n kanssa.
Tasapainovaikutus koskee myös vahvojen emästen liuoksia: Vesiliuoksessa kaikki OH-:aa vahvemmat emäkset tasoittuvat OH-:n vahvuuteen, koska OH- on vahvin emäs, joka voi olla tasapainossa veden kanssa. Sellaiset suolat kuin \(K_2O\), \(NaOCH_3\) (natriummetoksidi) ja \(NaNH_2\) (natriumamidi), joiden anionit ovat sellaisten lajien konjugaattiemäksisiä emäksiä, jotka sijoittuisivat veden alapuolelle taulukossa \(\(\Sivuindeksi{2}\), ovat kaikki vahvoja emäksiä, jotka reagoivat olennaisesti täydellisesti (ja usein rajusti) veden kanssa, jolloin ne ottavat vastaan protonin ja tuottavat liuoksen, jossa on \(OH^-\) ja vastaava kationi:
\
\
\
Muita esimerkkejä, joihin saatat törmätä, ovat kaliumhydridi (\(KH\)) ja metalliorgaaniset yhdisteet, kuten metyylilitium (\(CH_3Li\)).
Polyprottiset hapot ja emäkset
Kuten opit, polyprottiset hapot, kuten \(H_2SO_4\), \(H_3PO_4\) ja \(H_2CO_3\), sisältävät useamman kuin yhden ionisoituvan protonin, ja protonit häviävät vaiheittain. Täysin protonoitu laji on aina vahvin happo, koska protonin poistaminen neutraalista molekyylistä on helpompaa kuin negatiivisesti varautuneesta ionista. Näin ollen hapon vahvuus vähenee seuraavien protonien menetyksen myötä, ja vastaavasti \(pK_a\) kasvaa. Tarkastellaan esimerkiksi \(H_2SO_4\):
\
Tasapaino ensimmäisessä reaktiossa on kaukana oikealla, mikä vastaa sitä, että \(H_2SO_4\) on vahva happo. Toisessa reaktiossa sen sijaan tasapainossa esiintyy huomattavia määriä sekä \(HSO_4^-\) että \(SO_4^{2-}\).
Polyprottisen hapon osalta hapon vahvuus pienenee ja \(pK_a\) kasvaa jokaisen protonin peräkkäisen menetyksen myötä.
Vetysulfaatti-ioni (\(HSO_4^-\)) on sekä \(H_2SO_4\) konjugoitu emäs että \(SO_4^{2-}\) konjugoitu happo. Aivan kuten vesi, HSO4- voi siis toimia joko happona tai emäksenä riippuen siitä, onko toinen reaktantti vahvempi happo vai vahvempi emäs. Sitä vastoin sulfaatti-ioni (\(SO_4^{2-}\)) on polyprottinen emäs, joka pystyy ottamaan kaksi protonia vaiheittain:
\
\
Kuten minkä tahansa muun konjugoidun happoemäsparin tapaan, konjugoitujen happojen ja emästen voimakkuudet liittyvät toisiinsa kaavalla: \(pK_a \) + \(pK_b \) = pKw. Tarkastellaan esimerkiksi \(HSO_4^-/ SO_4^{2-}\) konjugoitunutta happo-emäsparia. Taulukosta \(\PageIndex{1}\) nähdään, että \(HSO_4^-\) \(pK_a\) on 1,99. Näin ollen \(SO_4^{2-}\) \(pK_b\) on 14,00 – 1,99 = 12,01. Sulfaatti on siis melko heikko emäs, kun taas \(OH^-\) on vahva emäs, joten yhtälössä \(\ref{16.6}\) esitetty tasapaino on vasemmalla.
Esimerkki \(\PageIndex{2}\)
Arvioi, sijaitseeko kunkin reaktion tasapaino vasemmalla vai oikealla, kuten kirjoitettu.
- \(NH^+_{4(aq)}+PO^{3-}_{4(aq)}+PO^3-}_{4(aq)} \rightleftharpoons NH_{3(aq)}+HPO^{2−}_{4(aq)}\)
- \(CH_3CH_2CO_2H_{(aq)}+CN^−_{(aq)} \rightleftharpoons CH_3CH_2CO^-_{2(aq)}+HCN_{(aq)}\)
Annettu: tasapainotettu kemiallinen yhtälö
Kysytty: tasapainoasento
Strategia:
Tunnista konjugoidut happo-emäsparit kussakin reaktiossa. Katso sitten taulukoista \(\PageIndex{1}\)ja\(\PageIndex{2}\) ja kuvasta \(\PageIndex{2}\), kumpi on vahvempi happo ja emäs. Tasapaino suosii aina heikomman happo-emäsparin muodostumista.
Liuos:
Konjugoituneet happo-emäsparit ovat \(NH_4^+/NH_3\) ja \(HPO_4^{2-}/PO_4^{3-}\). Taulukoiden \(\PageIndex{1}\) ja \(\PageIndex{2}\) mukaan \(NH_4^+\) on vahvempi happo (\(pK_a = 9.25\)) kuin \(HPO_4^{2-}\) (pKa = 12,32), ja \(PO_4^{3-}\) on vahvempi emäs (\(pK_b = 1,68\)) kuin \(NH_3\) (\(pK_b = 4,75\)). Tasapaino on siis oikealle, mikä suosii heikomman happo-emäsparin muodostumista:
\
Konjugoituneet happo-emäsparit ovat \(CH_3CH_2CO_2H/CH_3CH_2CO_2^-\) ja \(HCN/CN^-\). Taulukon \(\PageIndex{1}\) mukaan HCN on heikko happo (pKa = 9,21) ja \(CN^-\) on kohtalaisen heikko emäs (pKb = 4,79). Propionihappoa (\(CH_3CH_2CO_2H\)) ei kuitenkaan mainita taulukossa \(\PageIndex{1}\). Tällaisessa tilanteessa paras tapa on etsiä samanlainen yhdiste, jonka happo-emäsominaisuudet on lueteltu. Esimerkiksi propionihappo ja etikkahappo ovat identtisiä lukuun ottamatta karboksyylihapon hiiliatomiin kiinnittyneitä ryhmiä (\(\ce{-CH_2CH_3}\) vs. \(\ce{-CH_3}\)), joten näillä kahdella yhdisteellä voisi olettaa olevan samanlaiset happo-emäsominaisuudet. Erityisesti odotamme, että propionihapon \(pK_a\) on samansuuruinen kuin etikkahapon \(pK_a\). (Itse asiassa propionihapon \(pK_a\) on 4,87, kun etikkahapon \(pK_a\) on 4,76, mikä tekee propionihaposta hieman etikkahappoa heikomman hapon). Propionihapon pitäisi siis olla huomattavasti vahvempi happo kuin \(HCN\). Koska vahvempi happo muodostaa heikomman konjugaattiemäksen, ennustamme, että syanidi on vahvempi emäs kuin propionaatti. Tasapaino on siis oikealle, mikä suosii heikomman happo-emäsparin muodostumista:
\
Harjoitus \(\PageIndex{1}\)
Arvioi, onko kunkin reaktion tasapaino vasemmalle vai oikealle, kuten kirjoitettu.
- \(H_2O_(l)}+HS^-_{(aq)} \rightleftharpoons OH^−_{(aq)}+H_2S_{(aq)}\)
- \(HCO^−_{2(aq)}+HSO^−_{4(aq)} \rightleftharpoons HCO_2H_{(aq)}+SO^{2-}_{4(aq)}\)
Vastaus a
leftharpoons
Vastaus b
leftharpoons
Yhteenveto
Happoemäksiset reaktiot sisältävät aina kaksi konjugoitunutta happoemäksistä happoa. Jokaiseen happoon ja jokaiseen emäkseen liittyy ionisaatiovakio, joka vastaa sen happo- tai emäsvahvuutta. Kaksi lajia, jotka eroavat toisistaan vain protonin verran, muodostavat konjugoituneen happo-emäsparin. Ionisaatioreaktion tasapainovakion suuruutta voidaan käyttää happojen ja emästen suhteellisten vahvuuksien määrittämiseen. Heikon hapon vesiliuoksen dissosiaatiovakiota kutsutaan happoionisaatiovakioksi (\(K_a\)). Vastaavasti heikon emäksen ja veden välisen reaktion tasapainovakio on emäksen ionisaatiovakio (\(K_b\)). Minkä tahansa konjugoituneen happo-emäsparin tapauksessa \(K_aK_b = K_w\). Pienemmät \(pK_a\) -arvot vastaavat suurempia happoionisaatiovakioita ja siten vahvempia happoja. Vastaavasti pienemmät \(pK_b\) arvot vastaavat suurempia emäksen ionisaatiovakioita ja siten vahvempia emäksiä. 25 °C:ssa \(pK_a + pK_b = 14,00\). Happo-emäsreaktiot etenevät aina siihen suuntaan, joka tuottaa heikomman happo-emäsparin. Vesiliuoksessa ei voi esiintyä happoa, joka on vahvempi kuin \(H_3O^+\), eikä emästä, joka on vahvempi kuin \(OH^-\), mikä johtaa ilmiöön, joka tunnetaan nimellä tasoitusilmiö. Polyprotoniset hapot (ja emäkset) menettävät (ja saavat) protoneja asteittain, jolloin täysin protonoitunut laji on vahvin happo ja täysin deprotonoitunut laji vahvin emäs.
Avainyhtälöt
- Hapon ionisaatiovakio: \=\dfrac{}{} \]
- Emäsionisaatiovakio: \= \dfrac{}{} \\]
- Konjugoidun happo-emäsparin \(K_a\) ja \(K_b\) välinen suhde: \
- Määritelmä \(pK_a\): \ \
- Määritelmä \(pK_b\): \ \
- Konjugaattihappo-emäsparin \(pK_a\) ja \(pK_b\) välinen suhde: \ \
Tekijät ja attribuutiot
-
Stephen Lower, emeritusprofessori (Simon Fraser U.) Chem1 Virtual Textbook