Entropia
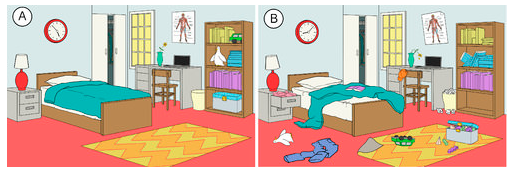
Systeemeillä on luonnossa taipumus edetä kohti suurempaa epäjärjestystä tai satunnaisuutta. Entropia on systeemin satunnaisuuden tai epäjärjestyksen asteen mitta. Entropia on helppo käsite ymmärtää, kun ajatellaan jokapäiväisiä tilanteita. Hiljattain siivotun ja järjestetyn huoneen entropia on alhainen. Ajan kuluessa se todennäköisesti muuttuu epäjärjestyneemmäksi ja siten sen entropia kasvaa (ks. alla oleva kuva). Systeemin luonnollinen taipumus on, että sen entropia kasvaa.
Kemiallisilla reaktioilla on myös taipumus edetä siten, että systeemin kokonaisentropia kasvaa. Mistä voi päätellä, näkyykö tietyssä reaktiossa entropian lisääntyminen vai väheneminen? Reaktanttien ja tuotteiden molekyylitila antaa tiettyjä vihjeitä. Alla olevat yleistapaukset havainnollistavat entropiaa molekyylitasolla.
- Tietyllä aineella nestemäisen tilan entropia on suurempi kuin kiinteän tilan entropia. Samoin kaasun entropia on suurempi kuin nesteen entropia. Siksi entropia kasvaa prosesseissa, joissa kiinteät tai nestemäiset reagoivat aineet muodostavat kaasumaisia tuotteita. Entropia kasvaa myös silloin, kun kiinteät reaktantit muodostavat nestemäisiä tuotteita.
- Entropia kasvaa, kun aine hajoaa useisiin osiin. Liukenemisprosessi lisää entropiaa, koska liuenneen aineen hiukkaset erkanevat toisistaan liuoksen muodostuessa.
- Entropia kasvaa lämpötilan noustessa. Lämpötilan nousu tarkoittaa, että aineen hiukkasilla on suurempi liike-energia. Nopeammin liikkuvilla hiukkasilla on enemmän epäjärjestystä kuin hitaammin liikkuvilla hiukkasilla alhaisemmassa lämpötilassa.
- Entropia kasvaa yleensä reaktioissa, joissa tuotemolekyylien kokonaismäärä on suurempi kuin reagoivien molekyylien kokonaismäärä. Poikkeuksena tähän sääntöön on, kun kaasua tuotetaan kaasuttomista reaktioaineista.
Alla olevat esimerkit havainnollistavat, miten reaktiossa tapahtuva entropian muutos voidaan ennustaa.
\(\ce{Cl_2}) \left( g \right) \rightarrow \ce{Cl_2} \left( l \right)\)
Entropia pienenee, koska kaasu muuttuu nesteeksi.
\(\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right)\)
Entropia kasvaa, koska syntyy kaasua ja molekyylien määrä kasvaa.
\(\ce{N_2} \left( g \right) + 3 \ce{H_2} \left( g \right) \rightarrow 2 \ce{NH_3} \left( g \right)\)
Entropia pienenee, koska yhteensä neljä reagoivaa molekyyliä muodostaa yhteensä kaksi tuotemolekyyliä. Kaikki ovat kaasuja.
\(\ce{AgNO_3}) \left( aq \right) + \ce{NaCl} \left( aq \right) \rightarrow \ce{NaNO_3} \left( aq \right) + \ce{AgCl} \left( s \right)\)
Entropia pienenee, koska vesipitoisista reaktioaineista muodostuu kiinteä aine.
\(\ce{H_2} \left( g \right) + \ce{Cl_2} \left( g \right) \rightarrow 2 \ce{HCl} \left( g \right)\)
Entropian muutos on tuntematon (mutta todennäköisesti ei nolla), koska yhtälön molemmilla puolilla on yhtä monta molekyyliä ja kaikki ovat kaasuja.