Atomimalli
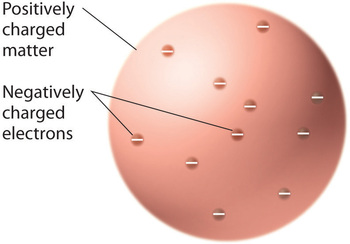
Kun tiedemiehet tulivat siihen tulokseen, että kaikessa aineessa on negatiivisesti varautuneita elektroneja, kävi selväksi, että sähköisesti neutraaleissa atomeissa on oltava myös positiivisia varauksia negatiivisten varausten vastapainoksi. Thomson ehdotti, että elektronit olivat upotettuina yhtenäiseen palloon, joka sisälsi sekä positiivisen varauksen että suurimman osan atomin massasta, samaan tapaan kuin rusinat luumupuddingissa tai suklaalastut keksissä (kuva \(\PageIndex{9}\))
2.4.6
Kuva \(\PageIndex{9}\): Thomsonin luumupudding- tai suklaakeksimalli atomista. Tässä mallissa elektronit on upotettu yhtenäiseen positiivisen varauksen palloon. Kuvaa käytetään luvalla (CC BY-SA-NC).
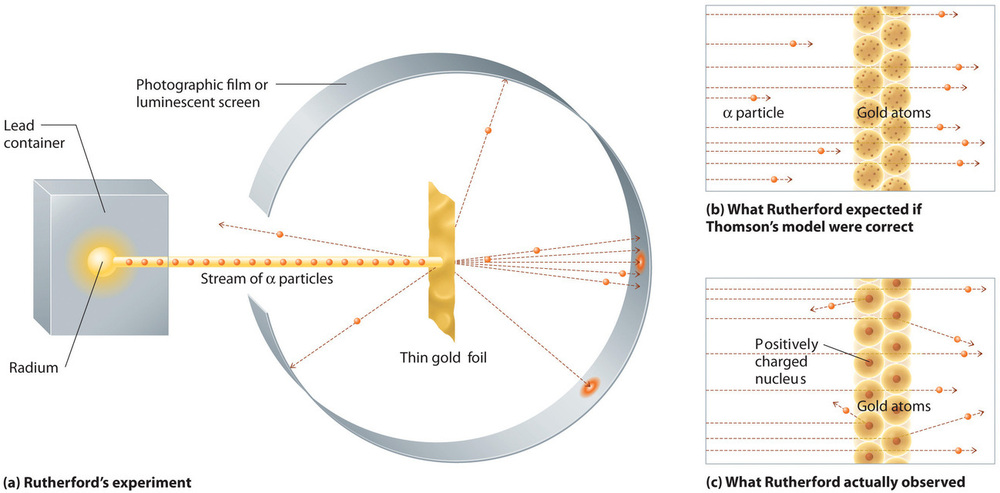
Yhden kuuluisan kokeen avulla Rutherford kuitenkin osoitti yksiselitteisesti, että Thomsonin atomimalli oli virheellinen. Rutherford kohdisti α-hiukkasten virran hyvin ohueen kultakalvokohteeseen (kuva \(\PageIndex{10a}\)) ja tutki, miten α-hiukkaset hajosivat kalvoon. Kulta valittiin, koska se voitiin helposti vasaroida erittäin ohuiksi levyiksi, jolloin kohteen atomien määrä minimoitiin. Jos Thomsonin atomimalli olisi oikea, positiivisesti varattujen α-hiukkasten pitäisi törmätä kultakohteen tasaisesti jakautuneen massan läpi kuin tykinkuulat puutalon kyljen läpi. Ne saattoivat liikkua hieman hitaammin, kun ne tulivat ulos, mutta niiden pitäisi kulkea periaatteessa suoraan kohteen läpi (kuva \(\PageIndex{10b}\))Rutherfordin hämmästykseksi pieni osa α-hiukkasista taipui suuriin kulmiin, ja osa heijastui suoraan takaisin lähteeseen (kuva \(\PageIndex{10c}\)). Rutherfordin mukaan ”Se oli melkein yhtä uskomatonta kuin jos ampuisit 15-tuumaisella kranaatilla pehmopaperia ja se tulisi takaisin ja osuisi sinuun.”
2.4.7
Kuva \(\PageIndex{10}\): Rutherfordin kokeiden yhteenveto. (a) Esitys laitteesta, jota Rutherford käytti havaitakseen ohueen kultakalvokohteeseen suunnatun α-hiukkasvirran poikkeamat. Hiukkaset olivat peräisin radiumnäytteestä. (b) Jos Thomsonin atomimalli olisi oikea, α-hiukkasten olisi pitänyt kulkea suoraan kultakalvon läpi. (c) Pieni määrä α-hiukkasia kuitenkin harhautui eri suuntiin, muun muassa suoraan takaisin lähteeseen. Tämä voisi pitää paikkansa vain, jos positiivinen varaus olisi paljon massiivisempi kuin α-hiukkanen. Se viittasi siihen, että kulta-atomin massa on keskittynyt hyvin pienelle avaruusalueelle, jota hän kutsui ytimeksi. Kuvaa käytetty luvalla (CC BY-SA-NC).
Rutherfordin tulokset eivät olleet sopusoinnussa sellaisen mallin kanssa, jossa massa ja positiivinen varaus jakautuvat tasaisesti koko atomin tilavuuteen. Sen sijaan ne viittasivat vahvasti siihen, että sekä massa että positiivinen varaus ovat keskittyneet pieneen murto-osaan atomin tilavuudesta, jota Rutherford kutsui ytimeksi. Oli järkevää, että pieni osa α-hiukkasista törmäsi tiheään, positiivisesti varautuneeseen ytimeen joko välähdyksenomaisesti, mikä johti suuriin poikkeamiin, tai lähes suoraan päin, jolloin ne heijastuivat suoraan takaisin lähteeseen.
Vaikka Rutherford ei osannut selittää, miksi positiivisten varausten väliset vastukset ytimissä, jotka sisälsivät enemmän kuin yhden positiivisen varauksen, eivät aiheuttaneet ytimen hajoamista, hän päätteli, että negatiivisesti varautuneiden elektronien väliset vastukset saisivat aikaan sen, että elektronit jakaantuisivat tasaisesti koko atomin tilavuuteen. nykyään tiedetään, että vahvat ydinvoimat, jotka ovat paljon voimakkaampia kuin sähköstaattiset vuorovaikutukset, pitävät protonit ja neutronit yhdessä ytimessä. Tästä ja muista oivalluksista Rutherford sai Nobelin kemianpalkinnon vuonna 1908. Valitettavasti Rutherford olisi mieluummin saanut fysiikan Nobel-palkinnon, koska hän piti fysiikkaa kemiaa parempana. Hänen mielestään ”Kaikki tiede on joko fysiikkaa tai postimerkkien keräilyä.”
 2.4.8
2.4.8
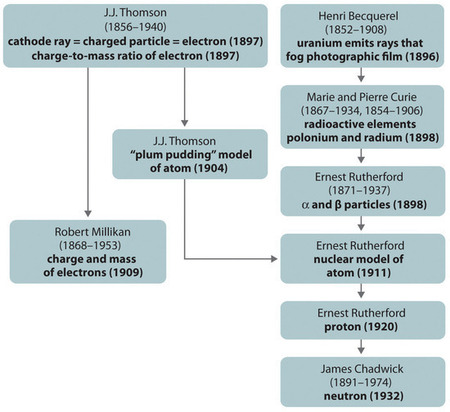
Kuva \(\PageIndex{11}\): Yhteenveto atomin komponenttien ja rakenteen mallien historiallisesta kehityksestä. Suluissa olevat päivämäärät ovat vuosia, jolloin keskeiset kokeet suoritettiin. Kuvaa käytetty luvalla (CC BY-SA-NC).
Atomin rakennetta kuvaavien eri mallien historiallinen kehitys on tiivistetty (Kuva \(\PageIndex{11}\)). Rutherford totesi, että vetyatomin ydin oli positiivisesti varautunut hiukkanen, jolle hän keksi nimen protoni vuonna 1920. Hän esitti myös, että muiden alkuaineiden kuin vedyn ytimissä on oltava sähköisesti neutraaleja hiukkasia, joilla on suunnilleen sama massa kuin protonilla. Neutroni löydettiin kuitenkin vasta vuonna 1932, kun James Chadwick (1891-1974, Rutherfordin oppilas; Nobelin fysiikanpalkinto 1935) löysi sen. Rutherfordin työn tuloksena tuli selväksi, että α-hiukkanen sisältää kaksi protonia ja neutronia ja on siten heliumatomin ydin.
2.4.9
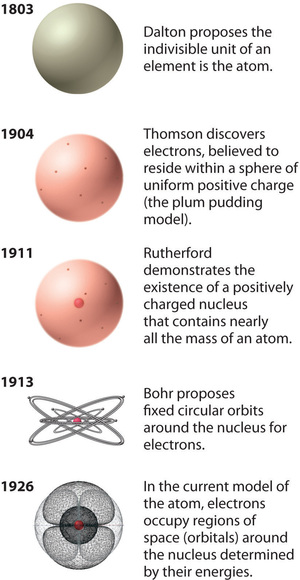
Kuvio \(\PageIndex{12}\): Atomiteorian kehitys havainnollistettuna happiatomin malleilla. Bohrin mallia ja nykyistä mallia kuvataan luvussa 6 ”Atomien rakenne”. Kuvaa käytetään luvalla (CC BY-SA-NC).
Rutherfordin atomimalli on periaatteessa sama kuin nykyaikainen malli, paitsi että nyt tiedetään, että elektronit eivät ole jakautuneet tasaisesti koko atomin tilavuuteen. Sen sijaan ne jakautuvat kvanttimekaniikan kuvaamien periaatteiden mukaisesti. Kuvassa \(\PageIndex{12}\) esitetään, miten atomimalli on kehittynyt ajan myötä Daltonin jakamattomasta yksiköstä nykyisin opetettavaan moderniin näkemykseen.