Esittely
Haimasyövällä tarkoitetaan tyypillisesti haiman duktaalista karsinoomaa, joka käsittää jopa 90 % primaarisista haiman pahanlaatuisista kasvaimista. Loppuosa voidaan jakaa eksokriinisiin kasvaimiin (kuten haiman kystinen karsinooma) ja endokriinisiin kasvaimiin (jotka ovat peräisin haiman saarekesoluista).
Haimasyövillä on korkea kuolleisuus, ja ne ovat neljänneksi yleisin syöpäkuolemien syy Yhdistyneessä kuningaskunnassa. Se on harvinainen alle 40-vuotiaana, ja 80 % tapauksista esiintyy 60-80-vuotiaana. Se diagnosoidaan harvoin riittävän varhain parantavaa hoitoa varten.
Tässä artikkelissa tarkastellaan haimasyöpäpotilaan riskitekijöitä, tutkimuksia ja hoitoa.
Patofysiologia
Haimasyövän yleisin tyyppi on duktaalinen karsinooma (90 % primaarisista haiman pahanlaatuisista sairauksista). Muita harvinaisempia muotoja ovat kystiset kasvaimet, ampullarisolukasvaimet ja saarekesolukasvaimet, joiden kaikkien ennuste on usein paljon parempi.
Syövän levittäytyessä suora invaasio paikallisiin rakenteisiin koskee tyypillisesti pernaa, poikittaispuolta ja lisämunuaisia. Lymfaattinen etäpesäke koskee tyypillisesti alueellisia imusolmukkeita, maksaa, keuhkoja ja vatsakalvoa. Metastaasit ovat yleisiä diagnoosihetkellä.
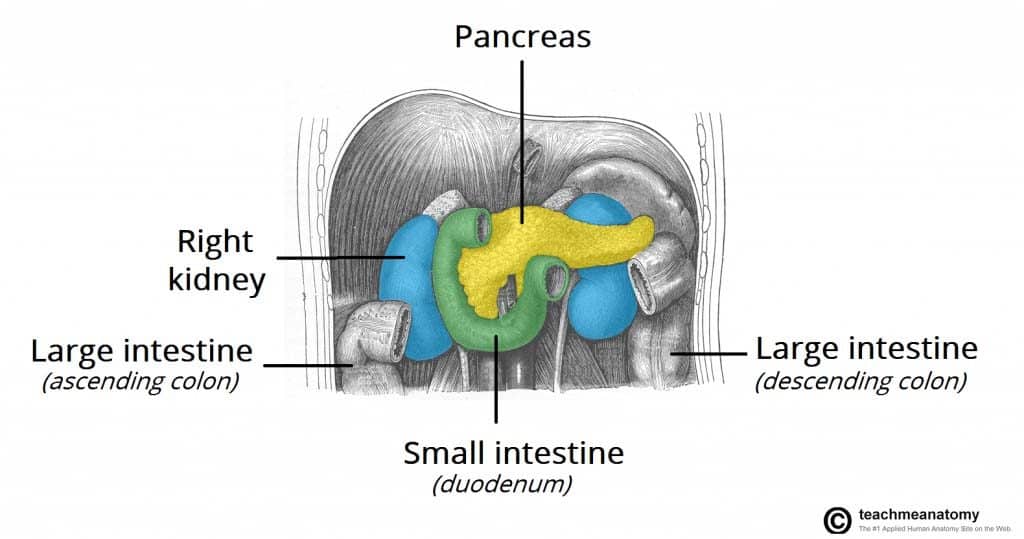 Kuva 1 – Haimasyöpä voi levitä suoraan ympäröiviin rakenteisiin, kuten pernaan, poikittaiseen paksusuoleen ja lisämunuaiseen.
Kuva 1 – Haimasyöpä voi levitä suoraan ympäröiviin rakenteisiin, kuten pernaan, poikittaiseen paksusuoleen ja lisämunuaiseen.Riskitekijät
Haimasyövän kehittymiselle on vain vähän selkeitä riskitekijöitä. Niitä, jotka on tunnistettu, ovat tupakointi ja krooninen haimatulehdus. Myös perinnöllinen tekijä voi olla olemassa, sillä 7 %:lla potilaista on suvussa esiintynyt tautia.
Viivästynyt diabetes mellitus on ylimääräinen riskitekijä. Niillä, joilla diabetes on diagnosoitu >50-vuotiaana, on 8-kertainen riski sairastua haimakarsinoomaan seuraavien kolmen vuoden aikana verrattuna väestöön yleensä.
Kliininen taudinkuva
Noin 80 % haimakarsinoomatapauksista on diagnoosin tekohetkellä leikkauskelvottomia, mikä on osoitus siitä, että taudinkuva on myöhäinen ja usein epämääräinen ja epäspesifi.
Kliiniset erityispiirteet* voivat riippua kasvaimen sijainnista:
- Obstruktiivinen keltaisuus – johtuu yhteisen sappitiehyen puristumisesta (esiintyy 90 %:lla tapauksista diagnoosihetkellä), tyypillisesti kivuton
- Painonlasku – johtuu syövän metabolisista vaikutuksista, tai eksokriinisen toimintahäiriön seurauksena
- Vatsakipu (epäspesifinen) – johtuen plexus coeliacuksen invaasiosta tai haimatulehduksen seurauksena
Harvinaisempia esiintymismuotoja ovat mm. akuutti haimatulehdus tai migrans-tromboflebiitti (toistuva migraatiomuotoinen pinnallinen tromboflebiitti, jonka aiheuttaa paraneoplastinen hyperkoaguloituva tila).
*Haiman häntäkasvaimet ovat salakavalasti eteneviä, ja ne oireilevat usein vasta myöhäisessä vaiheessa
Tutkimuksessa potilaat voivat vaikuttaa kakektisilta, aliravittuina ja keltaisina. Palpaatiossa voi tuntua epigastrisen alueen vatsamassa sekä suurentunut sappirakko (Courvoisier’n lain mukaan)
Courvoisier’n laki
Courvoisier’n lain mukaan keltaisuuden ja suurentuneen/palpaatiokelpoisen sappirakon esiintyessä, sappiteiden tai haiman pahanlaatuisuutta on epäiltävä vahvasti, koska syy ei todennäköisesti ole sappikivet.
Tämä merkki voi esiintyä, jos tukkeutuva kasvain on distaalisesti kystiseen kanavaan nähden. Todellisuudessa suurentunut sappirakko esiintyy alle 25 prosentilla potilaista, joilla on haimasyöpä.
Differentiaalidiagnostiikka
Haimasyöpä ilmaantuu usein epämääräisin, epäspesifisin piirtein. Erotusdiagnoosit ovat laajat ja niihin kuuluvat mm:
- Obstruktiivisen keltaisuuden syyt – sappikivitauti, kolangiokarsinooma, hyvänlaatuinen sappirakon ahtauma
- Epigastrisen vatsakivun syyt – sappikivet, mahahaavan tauti, mahalaukun karsinooma,
CA19-9 on kasvaimen merkkiaine, jolla on suuri herkkyys ja spesifisyys haimasyövälle, mutta sen merkitys on kuitenkin pikemminkin hoidon vasteen arvioinnissa kuin alkudiagnostiikassa.
Kuvantaminen
Haimasyövän alkukuvantaminen on tavallisesti vatsaontelon ultraäänitutkimus, jossa voidaan havaita haimamassan tai laajentuneen sappitiehyen esiintyminen (samoin kuin mahdollisia maksametastasointeja ja askitesta, jos kyseessä on hyvin myöhäisvaiheinen tauti).
CT-kuvantaminen (haimaprotokollaa käyttäen, kuva 2) on sekä tärkein tutkimus diagnoosin kannalta että myös ennusteellisesti informatiivisin, koska sillä voidaan vaiheistaa taudin eteneminen. Kun haimasyöpä on diagnosoitu, tarvitaan lisäksi rintakehän, vatsan ja lantion tietokonetomografiatutkimus vaiheistusta varten; PET-CT-tutkimus voi olla perusteltu niille, joiden tauti on paikallistettu tietokonetomografiassa ja jotka saavat syöpähoitoa
Endoskooppista ultraäänitutkimusta (EUS) voidaan sen jälkeen käyttää ohjattaessa ohuella neulalla tehtävää aspiraatiobiopsiaa, jotta leesio voidaan arvioida histologisesti, jos diagnoosi ei ole vielä selvä. ERCP:n avulla voidaan myös päästä leesioon käsiksi biopsiaa tai sytologiaa varten, jos se on sopivassa paikassa*.
*Sappitieharjaus sytologiaa varten, jos ERCP:tä käytetään sappitietukoksen poistamiseen eikä kudosdiagnoosia ole tehty.
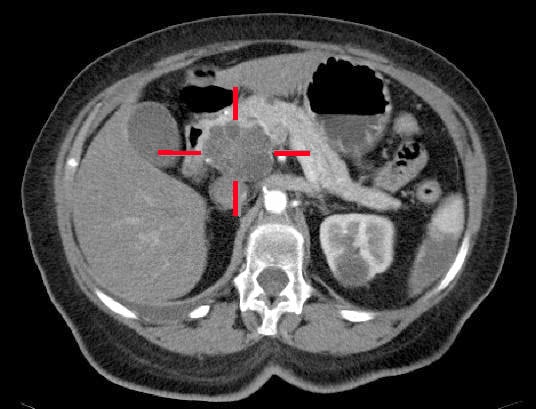 Kuva 2 – Haiman päässä sijaitseva adenokarsinooma, joka on tunnistettu tietokonetomografiassa
Kuva 2 – Haiman päässä sijaitseva adenokarsinooma, joka on tunnistettu tietokonetomografiassaHoito
Kirurgia
Ainut kuratiivinen hoitovaihtoehto on tällä hetkellä radikaali resektio:
- Potilaille, joilla on haiman pään kasvaimia, yleisin kuratiivisessa tarkoituksessa tehtävä leikkaus on pancreaticoduodenektomia, joka tunnetaan myös Whipplen toimenpiteenä
- Pylorusta säästäviä resektioita voidaan yrittää tietyissä tapauksissa
- Potilaille, joilla on haiman rungon tai hännän kasvaimia, distaalinen pankreatektomia voidaan usein tehdä
Absoluuttisia vasta-aiheita leikkaukselle ovat vatsakalvon, maksan ja etäpesäkkeiden etäpesäkkeet. Näihin toimenpiteisiin liittyy korkea sairastuvuus (jopa 40 %), ja erityisiä komplikaatioita ovat haimafistelin muodostuminen, viivästynyt mahalaukun tyhjeneminen ja haiman vajaatoiminta.
Cochrane-katsauksessa todettiin, että haiman resektio lisää eloonjäämisikää ja alentaa kustannuksia verrattuna palliatiivisiin hoitoihin potilailla, joilla on paikallisesti pitkälle edennyt haimasyöpä ja laskimotauti, edellyttäen, että kliinistä asiantuntemusta on riittävästi käytettävissä.
Whipplen toimenpide
Whipplen toimenpiteessä poistetaan haiman pää, mahalaukun antrum, pohjukaissuolen 1. ja 2. osa, yhteinen sappitie ja sappirakko.
Kaikki leikkauksessa poistettavat sisäelimet poistetaan niiden yhteisen valtimoverkoston (gastroduodenaalinen valtimo) vuoksi, joka on yhteinen haiman pään ja pohjukaissuolen kanssa.
Tämän jälkeen haiman häntä ja maksakanava liitetään jejunumiin, jolloin sappi- ja haimamehut voivat valua suolistoon, kun taas mahalaukku anastomosoidaan tämän jälkeen jejunumiin, jolloin ruoka pääsee kulkemaan.
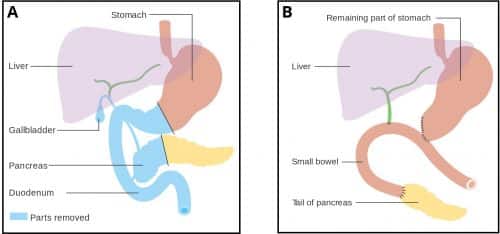 Kuva 3 – Haiman ja duodenektomia (Whipplen toimenpide). A: Ennen toimenpidettä, B: Toimenpiteen jälkeen
Kuva 3 – Haiman ja duodenektomia (Whipplen toimenpide). A: Ennen toimenpidettä, B: Toimenpiteen jälkeenSytostaattihoito
Adjuvantti solunsalpaajahoito, yleensä 5-fluurourasiilihoito, suositellaan leikkauksen jälkeen, koska sen on ESPAC-1-tutkimuksen* perusteella osoitettu parantavan eloonjäämistä.
Metastaattisessa taudissa suositellaan FOLFIRINOX-hoitoa (foliinihappo, 5-fluorourasiili, irinotekaani ja oksaliplatiini) niille, joiden suorituskyky on hyvä, mutta se on parantanut eloonjäämisaikaa vain vaatimattomasti; gemsitabiinihoitoa voidaan harkita niille potilaille, joilla on paikallisesti pitkälle edennyt haimasyövän tauti ja jotka eivät siedä FOLFIRINOXia.
*ESPAC-1 osoitti myös, että adjuvanttia kemosädehoitoa saaneiden potilaiden kokonaistulokset olivat huonommat kuin pelkkää adjuvanttia kemoterapiaa saaneiden.
Palliatiivinen hoito
Suurimmalle osalle haimasyöpäpotilaista ei voida tehdä kuratiivista leikkausta, vaan he tarvitsevat palliatiivista hoitoa.
Obstruktiivista keltaisuutta ja siihen liittyvää pruriittia voidaan helpottaa asettamalla sappitiesten stentti joko ERCP:n kautta tai perkutaanisesti.
Palliatiivista solunsalpaajahoitoa, esimerkiksi gemsitabiiniin pohjautuvaa hoitomuotoa, voidaan kokeilla potilailla, joilla on kohtuullisen hyvä suorituskyky.
Eksokriininen vajaatoiminta on yleistä pitkälle edenneessä taudissa tai potilailla, joille on tehty merkittävä haiman poistoleikkaus, ja se johtaa imeytymishäiriöön ja steatorreaan; tätä voidaan aluksi hoitaa entsyymikorvaushoidoilla (mukaan lukien lipaasit), kuten Creon®-valmisteella.
Ennuste
Haimasyövällä on suuri etäpesäkekapasiteetti jopa pienissä kasvaimissa. Haimasyövän ennuste on edelleen erittäin huono, ja 5 vuoden kokonaiselossaoloprosentti on <5 %.
Pääkohdat
- Haimasyöpä ilmaantuu usein obstruktiivisen keltaisuuden, vatsakivun tai painonpudotuksen yhdistelmänä
- Useimmat tapaukset havaitaan aluksi tietokonetomografiakuvauksessa, mutta ne vaativat kuitenkin kudosdiagnoosin biopsian avulla; CA19-9 on kasvaimen merkkiaine, jota käytetään taudin etenemisen seurantaan
- Määräävä hoito on kirurginen resektio, usein adjuvantti solunsalpaajahoito
- Haimasyövän viiden vuoden elossaololuku on alle 5 %
Haiman endokriiniset kasvaimet
Haiman endokriiniset kasvaimet voivat olla toiminnallisia tai ei-toiminnallisia. Toiminnalliset kasvaimet erittävät aktiivisesti hormoneja, ja niiden oireet liittyvät tähän, kun taas ei-toiminnalliset kasvaimet eivät eritä aktiivisesti hormoneja, ja kliiniset piirteet liittyvät pelkästään niiden pahanlaatuiseen leviämiseen.
Haiman endokriinisiin kasvaimiin liittyy usein multippeli endokriininen neoplasia 1 -oireyhtymä (MEN1); MEN1-oireyhtymä muodostuu tyypillisesti kilpirauhasen liikatoiminnasta (hyperparatyreoosista), endokriinisistä kasvaimista haimakasvaimissa (endokriiniset kasvaimet haimakudoksessa) ja aivolisäkkeen kasvaimista (tavallisimmin proplaktiinoomista).
Kliiniset piirteet
Solutyyppi Sekretoituva hormoni (kasvaimen nimi) Normaali fysiologinen toiminta . Toiminnallisen kasvaimen ominaisuudet G-solut Gastriini (gastriinooma) Stimuloi mahahapon vapautumista Zollinger-Ellisonin oireyhtymä, johtaa vaikeisiin, lääkehoidolle vastustuskykyisiin mahahaavoihin, joihin liittyy ripuli ja steatorrhoea α-solut Glukagoni (glukagonooma) Nostaa veren glukoosipitoisuutta Hyperglykemia, diabetes mellitus, ja nekrolyyttinen migraattinen eryteema β-solut Insuliini (insulinoma) Alentaa veren glukoosipitoisuutta Oireinen hypoglykemia, kuten hikoilu tai muuttunut psyykkinen tila, paranee hiilihydraattien kulutuksen myötä δ Solut Somatostatiini (somatostatinoma) Estäisi GH:n vapautumista, TSH:n ja prolaktiinin vapautumista aivolisäkkeen etuosasta sekä gastriinin Diabetes mellitus, steatorrhoea, sappikivet (kolekystokiniinin eston vuoksi), laihtuminen, ja akloorihydria (gastriinin estosta johtuen) Ei saarekesoluja Vasoaktiivinen suolistopeptidi (VIPoma) Veden ja elektrolyyttien erittyminen suolistoon. Suoliston sileän lihaksen rentoutuminen. Pitkittynyt runsas vetinen ripuli, vakava hypokalemia ja kuivuminen (tunnetaan myös nimellä Verner-Morrisonin oireyhtymä) Taulukko 1 – Haiman endokriiniset kasvaimet
Tutkinta
Kaikki tapaukset on käsiteltävä moniammatillisessa tiimipalaverissa, jossa hoitoa voidaan ohjata. Tietyt verikokeet voidaan lähettää riippuen epäillystä alatyypistä (taulukko 1)
Haiman NET:t tutkitaan parhaiten CT-kuvauksen, MRI-kuvauksen ja/tai endoskooppisen ultraäänitutkimuksen yhdistelmällä. Myös valtimonsisäistä kalsiumia digitaalisen subtraktioangiografian avulla voidaan käyttää insulinoomien ja gastrinoomien lokalisoinnissa ja arvioinnissa.
Hoito
Pienet, ei-toiminnalliset, hyvin erilaistuneet haiman NET:t (<1 cm) voidaan yksinkertaisesti todeta. Suuremmat tai toimintakykyiset kasvaimet resekoidaan, ja myös mahdollinen etämetastaattinen tauti resekoidaan, jos kasvain on matala-asteinen ja etäpesäkkeet ovat tilavuudeltaan vähäisiä.
Somatostatiinianalogeja voidaan käyttää hormonaalisen liikeruiskutuksen vaikutusten hallitsemiseksi ja lieventämiseksi (myös somatostatinoomien tapauksessa).
- Potilaille, joilla on haiman pään kasvaimia, yleisin kuratiivisessa tarkoituksessa tehtävä leikkaus on pancreaticoduodenektomia, joka tunnetaan myös Whipplen toimenpiteenä