Kemiallinen alkuaine helium luokitellaan jalokaasuksi ja epämetalliksi. Sen löysi vuonna 1895 William Ramsay.

Tietovyöhyke
| Luokitus: | Helium on jalokaasu ja ei-metalli |
| Väri: | väritön |
| Atomipaino: | 4.00260 |
| Tila: | kaasu |
| Sulamispiste: | -272,2 oC, 0,95 K |
| Huomautus: Normaalissa ilmanpaineessa helium ei jähmety eikä sillä näin ollen ole sulamispistettä. Edellä mainittu sulamispiste on 25 ilmakehän paineessa. | |
| Kiehumispiste: | -268,9 oC, 4.2 K |
| Elektronit: | 2 |
| Protonit: | 2 |
| Neutronit runsaimmassa isotoopissa: | 2 |
| Elektronikuoret: | 2 |
| Elektronikonfiguraatio: | 1s2 |
| Tiheys @ 20oC: | 0.0001787 g/cm3 |
Näytä lisää, mm: Lämmöt, energiat, hapettuminen,
reaktiot, yhdisteet, säteet, johtavuudet
| Atomitilavuus: | 27.2 cm3/mol |
| Rakenne: | tavallisesti heksagonaalinen tiiviisti pakattu |
| (v.Heliumin jähmettymiseen tarvittava korkea paine) | |
| Ominaislämpökapasiteetti | 5.193 J g-1 K-1 |
| Sulamislämpö | 0.0138 kJ mol-1 |
| Atomisoitumislämpö | 0 |
| Höyrystymislämpö | 0.0845 kJ mol-1 |
| 1. ionisaatioenergia | 2372.3 kJ mol-1 |
| 2. ionisaatioenergia | – |
| 3. ionisaatioenergia | – |
| Elektronin affiniteetti | 0 kJ mol.1 |
| Minimi hapetusluku | 0 |
| Min. yhteinen hapettumisluku | 0 |
| Suurin hapettumisluku | 0 |
| Max. yhteinen hapettumisluku. | 0 |
| Elektronegatiivisuus (Paulingin asteikko) | – |
| Polarisoituvuuden määrä | 0.198 Å3 |
| Reaktio ilman kanssa | ei ole |
| Reaktio 15 M HNO3 | ei ole |
| Reaktio 6 M HCl | ei ole |
| Reaktio 6 M NaOH:n kanssa | ei ole |
| Oksidi(t) | ei ole |
| Hydridi(t) | ei ole |
| Kloridi(t) | ei ole |
| Atomisäde | 31 pm |
| Ioninen säde (1+-ioni) | – |
| Ionisäde (2+-ioni) | – |
| Ionisäde (3+-ioni) | – |
| Ionisäde (1- ioni) | – |
| Ionisäde (2-ioni) | – |
| Ionisäde (3-ioni) | – |
| Lämmönjohtavuus | 0.15 W m-1 K-1 |
| Sähkönjohtavuus | – |
| Jäätymis-/sulamispiste: | -272.2 oC, 0.95 K |

Nasa: Ionisoituneet heliumatomit noin 60 000 °C:n lämpötilassa Auringon kromosfäärissä säteilevät kuvassa näkyvää ultraviolettivaloa.
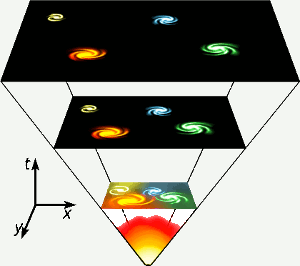
Helium syntyi maailmankaikkeuden olemassaolon kolmen ensimmäisen minuutin aikana, kun lämpötila oli kaikkialla riittävän korkea ydinfuusion tapahtumiseen. Tämä lyhyt, korkeaenerginen vaihe on esitetty aivan kaavion alareunassa. Heliumia syntyy myös vedyn ydinfuusiossa oman tähtemme kaltaisissa tähdissä. Kuva: Gnixon
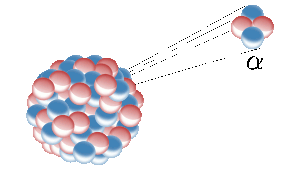
Heliumia maapallolla saadaan radioaktiivisten alkuaineiden, kuten uraanin, ydinfissiosta. Tällöin radioaktiivinen ydin emittoi heliumytimen (joka tunnetaan myös alfahiukkasena). Kuva: Inductiveload

Heliumin spektri, jossa näkyvä keltainen viiva. Kuva: Nasa

William Ramsay osoittamassa jaksollisen järjestelmän viimeistä saraketta, joka sisältää jalokaasut (tai inertit). Ramsay sai Nobelin kemianpalkinnon vuonna 1904 työstään inerttien kaasujen löytämiseksi. Kuva: Vanity Fair
Heliumin löytäminen
Heliumin löytämisen tarina kietoutuu tähtien luonteen löytämiseen.
Aikoinaan ihmiset uskoivat, ettemme koskaan saisi tietää, mistä tähdet koostuvat. Vuonna 1835 ranskalainen filosofi Auguste Comte julisti: ”Emme koskaan pysty millään keinolla tutkimaan niiden kemiallista koostumusta”. (1)
Comte ajatteli, että voisimme oppia, mitä tähtien aineet ovat, vain jos saisimme niitä laboratorioon.
Comten pessimismistä huolimatta menetelmä heliumin ja tähtien koostumusten löytämiseksi oli jo löydetty. Vuonna 1814 saksalainen fyysikko Joseph Fraunhofer oli ottanut käyttöön Isaac Newtonin menetelmän jakaa auringonvalo prisman avulla ja tehnyt ratkaisevan edistysaskeleen. Fraunhofer oli havainnut tummia viivoja sateenkaaren väreissä, jotka olivat peräisin prisman jakamasta auringonvalosta; hänen näkemänsä viivat olivat ensimmäinen havainto tähden spektristä. (2), (3)
Vuonna 1859/60 saksalaiset tiedemiehet Gustav Kirchhoff ja Robert Bunsen tekivät valtavia harppauksia spektroskopian tieteen alalla, muun muassa havaitsemalla, että Fraunhoferin näkemät tummat viivat olivat kuin aineen sormenjälki.
Kirchhoffille ja Bunsenille oli luotu edellytykset löytää uusia alkuaineita tutkimalla aineiden palavasta valosta tulevaa valoa.
He löysivät cesiumin sinisten spektriviivojensa perusteella vuonna 1860 ja rubidiumin sinisten sinisten viivojensa avulla ja rubidiumin kahdesta punaisesta viivasta vuonna 1861. Sitten William Crookes löysi talliumin vuonna 1861 havaittuaan kirkkaan vihreän spektriviivan.
Kirchhoff ja Bunsen tutkivat auringon spektriä ja pystyivät päättelemään, että sen hehkuvassa ilmakehässä oli rautaa. (4)
Heliumin löytämiseen tarvittiin vielä muutama vuosi. Elokuussa 1868 oli vuorossa ensimmäinen täydellinen auringonpimennys sen jälkeen, kun Kirchhoffin ja Bunsenin työ oli julkaistu.
Ranskalainen tähtitieteilijä Pierre Janssen odotti auringonpimennystä, jotta hän voisi spektroskoopin avulla havainnoida protuberansseja auringon koronassa. Pimennystä seuraavien kahden viikon aikana Janssen kehitti menetelmän prominenssispektrien tallentamiseksi ilman pimennystä. Näissä spektreissä hän havaitsi keltaisen viivan. (5)
Viiva oli samankaltaisessa mutta ei identtisessä asemassa kuin natriumin spektrin viivat. Näitä kutsuttiin D1- ja D2-viivoiksi. Englantilainen tiedemies Norman Lockyer tutki uutta keltaista viivaa; myöhemmin sitä kutsuttiin D3-viivaksi. hän julkaisi tutkimuksensa viivasta tietoisena siitä, että se saattoi johtua uudesta alkuaineesta:
”…joten silloin tiesimme, ettemme olleet tekemisissä vedyn kanssa; näin ollen olimme tekemisissä alkuaineen kanssa, jota emme voineet saada laboratorioistamme, ja siksi otin vastuulleni keksiä sanan helium, ensinnäkin laboratoriokäyttöä varten”. (6)
Nimi helium tuli auringon kreikankielisestä sanasta helios.
Lockyerilla ja hänen työtoverillaan Edward Franklandilla oli useita muita ajatuksia keltaisen viivan mahdollisista syistä, minkä vuoksi he eivät ilmoittaneet uudesta alkuaineesta.
Vuoteen 1871 mennessä muutkin tiedemiehet olivat tietoisia tilanteesta. Lordi Kelvin keskusteli ”auringon ympärillä hehkuvan vedyn ja ’heliumin’ valon heijastumisesta”. ’Heliumin’ käyttöä seuraa alaviite sen selittämiseksi:
”Frankland ja Lockyer havaitsevat keltaisten protuberanssien antavan hyvin selvän kirkkaan viivan, joka ei ole kaukana D:stä, mutta jota ei tähän mennessä ole tunnistettu mihinkään maanpäälliseen liekkiin. Se näyttää viittaavan uuteen aineeseen, jota he ehdottavat kutsuttavan Heliumiksi.” (7)
Heliumin olemassaoloa eivät kuitenkaan kaikki hyväksyneet. (5)
Kaikki epäilykset hälvenivät, kun skotlantilainen kemisti William Ramsay eristi heliumin vuonna 1895 Lontoossa. Ramsay oli löytänyt argonin vuonna 1894; argon oli ensimmäinen jalokaasuista, joka löydettiin. Vuonna 1895 hän luki William Hillebrandin artikkelin, jossa hän kuvaili epäreaktiivista kaasua, joka vapautui, kun uraanimineraaliin, uraniittiin, lisättiin happoa. Hillebrand uskoi kaasun olevan typpeä.
Ramsay, joka uskoi, että kaasu saattoi sisältää argonia, toisti Hillebrandin kokeen käyttäen toista uraanimineraalia, cleveiittia, ja keräsi kaasun.
Hänen spektroskooppinsa osoitti typen, argonin ja yhden muun kaasun läsnäolon. Ramsay epäili, että se voisi olla heliumia, koska siinä näytti olevan D3-viiva. (8) Tietoisena siitä, että Lockyerilla ja William Crookesilla oli parempi spektroskooppi kuin hänen, hän lähetti heille näytteen kaasusta. Valitettavasti näyte ei ollut sopiva, joten Lockyer hankki näytteen uraniitista, uutti kaasun ja tutki sitä spektroskoopilla. Hän kirjoittaa: (8)
”Yksi kerrallaan tuntemattomat viivat, jotka olin havainnut auringossa vuonna 1868, havaittiin kuuluvan kaasuun.”
Kaasun spektri oli identtinen auringon ”heliumin” kanssa. Uusi alkuaine sai paikkansa jaksollisessa järjestelmässä.
Käy Chemicoolin Cool Helium Facts Page.

Eritys ja ominaisuudet
Haitalliset vaikutukset:
Heliumin ei tiedetä olevan myrkyllistä.
Ominaisuudet:
Helium on kevyt, hajuton, väritön, inertti, yksiatominen kaasu. Se voi muodostaa kaksiatomisia molekyylejä, mutta vain heikosti ja lähellä absoluuttista nollapistettä olevissa lämpötiloissa.
Heliumilla on alkuaineista alhaisin sulamispiste ja sen kiehumispiste on lähellä absoluuttista nollapistettä.
Muista alkuaineista poiketen helium ei jähmety, vaan se säilyy nestemäisenä absoluuttiseen nollapisteeseen (0 K) asti tavanomaisissa paineissa.
Heliumia tilapäisesti hengittäneen henkilön ääni kuulostaa korkealta.
Heliumin käyttötarkoitukset
Magneettikuvaus (MRI) on suurin heliumin käyttäjä. Heliumia käytetään magneettikuvauslaitteiden suprajohtavien magneettien jäähdyttämiseen.
Heliumia käytetään ilmapallojen (ilmalaivojen) täyttämiseen ja nestemäisen polttoaineen rakettien paineistamiseen.
Heliumin ja hapen seoksia käytetään keinotekoisena ”ilmana” sukeltajille ja muille paineen alaisena työskenteleville. Heliumia käytetään tavallisen ilman typen sijasta, koska pitkän sukelluksen jälkeen helium poistuu elimistöstä nopeammin kuin typpi, mikä mahdollistaa nopeamman dekompression.
Heliumia käytetään kaasusuojana valokaarihitsauksen läheisyydessä estäen esimerkiksi kuuman metallihitsauksen mahdollisen reaktion hapen kanssa. Kaasua käytetään puolijohdeteollisuudessa tuottamaan inertti ilmakehä pii- ja germaniumkiteiden kasvattamiseen. Sitä käytetään myös korkean lämpötilan kaasuna titaanin ja zirkoniumin valmistuksessa sekä kantokaasuna kaasukromatografiassa.
Runsaus ja isotoopit
Runsaus maankuori: 8 paino-osaa miljardissa, 43 osaa miljardissa mooleissa
Runsaus aurinkokunta: 23 % painosta, 7,4 % mooleissa
Kustannus, puhdas: 5,2 $/100g
Kustannus, irtotavarana: $/100g
Lähde: Lähes kaikki maapallolla oleva helium on syntynyt radioaktiivisen hajoamisen tuloksena. Suurimmat heliumin lähteet ovat Teksasin, Oklahoman ja Kansasin kaivoissa olevista maakaasuesiintymistä. Heliumia uutetaan maakaasusta, joka sisältää jopa 7 % heliumia, fraktioidulla tislauksella.
Isotoopit: Heliumilla on 8 isotooppia, joiden puoliintumisajat tunnetaan ja joiden massanumerot ovat 3-10. Luonnossa esiintyvä helium on sen kahden stabiilin isotoopin, 3He:n ja 4He:n, seos, joiden luonnolliset esiintyvyydet ovat 0,0001 % ja 99,999 %.

- Auguste Comte, Cours de Philosophie Positiivinen Project Gutenbergissä
- Keith J. Laidler, The World of Physical Chemistry, 1993, s179.
- The Era of Classical Spectroscopy, osoitteesta MIT Spectroscopy.
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics. 1900-luvun fysiikan matemaattiset ja käsitteelliset perusteet, 1984, Elsevier Science Publishers, s211
- Helge Kragh, Aurinkoinen elementti: A Reconsideration of Helium’s Early History., 2009, Annals of Science, 66:2, s157-182.
- J. Norman Lockyer, The Growth of our Knowledge of Helium., Science Progress, 1896, Vol 5., s249
- W. Thomson, Presidential Address, British Association for the Advancement of Science, 1871, (Address. XCIX).
- Sir Norman Lockyer, The Sun’s Place in Nature.., 1897, s. 47-48
Cite this Page
Verkkolinkitystä varten kopioi ja liitä jompikumpi seuraavista:
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
tai
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
Voidaksesi siteerata tätä sivua akateemisessa asiakirjassa, käytä seuraavaa MLA:n mukaista viittaustapaa:
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.