Generaattinen nimi: natriumpolystyreenisulfonaatti
annosmuoto: oraalinen / rektaalinen suspensio
Lääketieteellisesti tarkistanut Drugs.com. Viimeksi päivitetty 22. heinäkuuta 2020.
- Yleiskatsaus
- Haittavaikutukset
- Adostus
- Professori
- Vuorovaikutukset
- Lisätiedot
- Kionexin käyttöaiheet ja lääkkeen käyttö
- Kionexin annostus ja antotapa
- Yleistietoa
- Suositeltu annostus
- Valmistelu ja antotapa
- ANNOSMUODOT JA VAHVUUDET
- Vasta-aiheet
- Varoitukset ja varotoimet
- Suoliston nekroosi
- Elektrolyyttihäiriöt
- Nesteen ylikuormitus potilaille, jotka ovat herkkiä suurelle natriumin saannille
- Aspiraatiovaara
- Sitoutuminen muihin suun kautta annosteltaviin lääkkeisiin
- Haittavaikutukset
- Lääkeinteraktiot
- Yleiset yhteisvaikutukset
- Kationeja luovuttavat antasidit
- Sorbitoli
- KÄYTTÖ ERITYISRYHMISSÄ
- Raskausaika
- Imetys
- Pediatrinen käyttö
- Yliannostus
- Kionex Kuvaus
- Kionex – Kliininen farmakologia
- Toimintamekanismi
- Farmakodynamiikka
- Farmakokinetiikka
- Nonkliininen toksikologia
- Karsinogeneesi, mutageenisyys, hedelmällisyyden heikentyminen
- Valmistustapa/varastointi ja käsittely
- Potilaan neuvontatiedot
- PAKKAUS/ETIKETTI PAKKAUSSELOSTE
- Lisätietoa Kionexista (natriumpolystyreenisulfonaatti)
- Kuluttajan resurssit
- Ammattilaislähteet
- Seuraavat hoito-ohjeet
Kionexin käyttöaiheet ja lääkkeen käyttö
Kionexis on tarkoitettu hyperkalemian hoitoon.
Käytön rajoitukset:
Kionexia ei pidä käyttää henkeä uhkaavan hyperkalemian hätälääkkeenä, koska sen vaikutus alkaa viiveellä.
Kionexin annostus ja antotapa
Yleistietoa
Kionexia tulee antaa vähintään 3 tuntia ennen muita suun kautta otettavia lääkkeitä tai 3 tuntia niiden jälkeen. Potilaat, joilla on gastropareesi, saattavat tarvita 6 tunnin eron
Suositeltu annostus
Hoidon voimakkuus ja kesto riippuvat hyperkalemian vaikeusasteesta ja vastustuskyvystä.
Oraalinen
Kionexin keskimääräinen päivittäinen kokonaisannos aikuiselle on 15 g – 60 g, joka annetaan 15 g:n annoksena (neljä tasaista teelusikallista) yhdestä neljään kertaan vuorokaudessa.
Rektaalinen
Keskimääräinen aikuisen annos on 30 g – 50 g kuuden tunnin välein.
Valmistelu ja antotapa
Valmistetaan suspensio tuoreena ja käytetään 24 tunnin kuluessa.
Kionexia ei saa kuumentaa, sillä se voi muuttaa hartsin vaihto-ominaisuuksia.
Yksi tasainen teelusikallinen sisältää noin 3,5 g Kionexia ja 15 mEq natriumia.
Oraalinen suspensio
Suspensioi jokainen annos pieneen määrään vettä tai siirappia, noin 3-4 ml nestettä grammaa hartsia kohti. Annostellaan potilaan ollessa pystyasennossa.
Peräruiske
Alustavan puhdistavan peräruiskeen jälkeen työnnetään pehmeä, suurikokoinen (French 28) kumiletku peräsuoleen noin 20 cm:n matkalta siten, että kärki on reilusti sigmoideaalipaksusuolessa, ja teipataan paikalleen.
Annostellaan lämpimänä (ruumiinlämpöisenä) emulsiovoiteena 100 ml:aan vesipitoiseen kantaja-aineeseen, ja vedetään alaspäin 50:n ja 100:n ml:lla nestettä. Hieman paksumpaa suspensiota voidaan käyttää, mutta siitä ei saa muodostaa tahnaa.
Emulsiota annostelun aikana pitää varovasti liikutella. Hartsia on säilytettävä mahdollisimman pitkään ja sen jälkeen on tehtävä puhdistava peräruiske ei-natriumia sisältävällä liuoksella. Varmista, että käytetään riittävä määrä puhdistusliuosta (enintään 2 litraa).
ANNOSMUODOT JA VAHVUUDET
Kionex on kermanruskeasta vaaleanruskeaan vaihteleva, hienoksi jauhettu jauhe ja sitä on saatavana 454 g:n purkeissa.
Vasta-aiheet
Kionex on vasta-aiheinen potilaille, joilla on seuraavat sairaudet:
– Yliherkkyys polystyreenisulfonaattihartseille – Obstruktiivinen suolistosairaus – Vastasyntyneet, joilla on heikentynyt suoliston motiliteetti
Varoitukset ja varotoimet
Suoliston nekroosi
Kionexin käytön yhteydessä on raportoitu tapauksia, joissa on esiintynyt suoliston nekroosia, joista osa on johtanut kuolemaan, ja muita vakavia ruoansulatuskanavan haittatapahtumia (verenvuotoa, iskeemistä paksusuolentulehdusta, perforaatiota). Suurimmassa osassa näistä tapauksista raportoitiin sorbitolin samanaikaisesta käytöstä. Monissa tapauksissa esiintyi ruoansulatuskanavan haittatapahtumien riskitekijöitä, kuten ennenaikaisuus, aiempi suolistosairaus tai -leikkaus, hypovolemia sekä munuaisten vajaatoiminta ja vajaatoiminta. Sorbitolin samanaikaista antoa ei suositella.
– Käytä vain potilaille, joilla on normaali suolen toiminta. Vältä käyttöä potilailla, joilla ei ole ollut suolen toimintaa leikkauksen jälkeen. – Vältä käyttöä potilailla, joilla on riski ummetuksen tai impaation kehittymiselle (mukaan lukien potilaat, joilla on ollut impaatio, krooninen ummetus, tulehduksellinen suolistosairaus, iskeeminen paksusuolentulehdus, verisuonten suoliston ateroskleroosi, aiempi suolen resektio tai suolitukos). Lopeta käyttö potilailla, joille kehittyy ummetus.
Elektrolyyttihäiriöt
Valvo seerumin kaliumpitoisuutta hoidon aikana, koska vaikeaa hypokalemiaa voi esiintyä.
Kionex ei ole täysin selektiivinen kaliumille, ja hoidon aikana voi hävitä pieniä määriä myös muita kationeja, kuten magnesiumia ja kalsiumia. Seuraa kalsiumia ja magnesiumia Kionexia saavilla potilailla.
Nesteen ylikuormitus potilaille, jotka ovat herkkiä suurelle natriumin saannille
Jokainen 15 g:n Kionex-annos sisältää 1500 mg (60 mEq) natriumia. Tarkkaile natriumin saannille herkkiä potilaita (sydämen vajaatoiminta, hypertensio, turvotus) nesteen ylikuormituksen merkkien varalta. Muiden natriumlähteiden säätäminen voi olla tarpeen.
Aspiraatiovaara
Natriumpolystyreenisulfonaattihiukkasten hengittämisen aiheuttamia akuutin keuhkoputkentulehduksen tai keuhkoputkentulehduksen tapauksia on raportoitu. Potilailla, joilla on heikentynyt nielemisrefleksi, muuttunut tajunnan taso tai potilailla, joilla on taipumusta regurgitaatioon, voi olla suurentunut riski. Annostele Kionex potilaan ollessa pystyasennossa.
Sitoutuminen muihin suun kautta annosteltaviin lääkkeisiin
Kionex saattaa sitoa suun kautta annosteltavia lääkkeitä, mikä voi vähentää niiden imeytymistä ruoansulatuskanavasta ja johtaa tehon heikkenemiseen. Anna muut suun kautta otettavat lääkkeet vähintään 3 tuntia ennen Kionexia tai 3 tuntia sen jälkeen. Potilaat, joilla on gastropareesi, saattavat tarvita 6 tunnin eron. .
Haittavaikutukset
Jäljempänä mainittuja haittavaikutuksia käsitellään muualla merkinnöissä:
– Suolen nekroosi – Elektrolyyttihäiriöt – Aspiraatio
Kionexin hyväksynnän jälkeisen käytön aikana on todettu seuraavia haittavaikutuksia. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarmasti kokoisesta populaatiosta, niiden esiintymistiheyttä ei ole aina mahdollista arvioida luotettavasti eikä syy-yhteyttä lääkealtistukseen voida osoittaa.
Ruuansulatuskanava: anoreksia, ummetus, ripuli, ulosteen impaatio, ruoansulatuskanavan konkretiat (bezoarit), iskeeminen paksusuolentulehdus, pahoinvointi, haavaumat, oksentelu, vatsa-ärsytys, suolen tukkeutuminen (alumiinihydroksidipitoisuudesta johtuen)
Aineenvaihdunta: systeeminen alkaloosi
Lääkeinteraktiot
Yleiset yhteisvaikutukset
Muodollisia lääkeinteraktiotutkimuksia ei ole tehty ihmisillä.
Kionexilla on mahdollisuus sitoutua muihin lääkkeisiin. In vitro -sitoutumistutkimuksissa Kionexin osoitettiin sitovan merkittävästi testattuja suun kautta otettavia lääkkeitä (n=6). Myös litiumin ja tyroksiinin heikentynyttä imeytymistä on raportoitu Kionexin samanaikaisen käytön yhteydessä. Kionexin sitoutuminen muihin suun kautta otettaviin lääkkeisiin voi aiheuttaa heikentynyttä imeytymistä ruoansulatuskanavasta ja tehon heikkenemistä, kun se otetaan lähellä Kionexin antoaikaa. Anna Kionex vähintään 3 tuntia ennen tai 3 tuntia muiden suun kautta otettavien lääkkeiden jälkeen. Potilaat, joilla on gastropareesi, saattavat tarvita 6 tunnin eron. Seuraa kliinistä vastetta ja/tai veriarvoja mahdollisuuksien mukaan.
Kationeja luovuttavat antasidit
Kionexin samanaikainen oraalinen antaminen ei-imeytyvien kationeja luovuttavien antasidien ja laksatiivien kanssa voi vähentää hartsin kaliuminvaihtokykyä ja lisätä systeemisen alkaloosin riskiä.
Sorbitoli
Sorbitoli saattaa lisätä suolen nekroosin riskiä, eikä samanaikaista käyttöä suositella.
KÄYTTÖ ERITYISRYHMISSÄ
Raskausaika
Riskien yhteenveto
Kionex ei imeydy systeemisesti oraalisen tai rektaalisen annostelun jälkeen eikä äidille annostelun odoteta aiheuttavan riskiä sikiölle.
Imetys
Riskin yhteenveto
Kionex ei imeydy äidistä systeemisesti, joten imetyksen ei odoteta aiheuttavan riskiä imeväiselle.
Pediatrinen käyttö
Turvallisuutta ja tehoa koskevia tutkimuksia ei ole tehty lapsipotilailla.
Pediatrisilla potilailla, kuten aikuisillakin, Kionexin odotetaan sitovan kaliumia käytännöllisellä vaihtosuhteella 1mEq kaliumia 1 grammaa hartsia kohti.
Vastasyntyneille Kionexia ei saa antaa suun kautta. Sekä lapsilla että vastasyntyneillä liian suuri annos tai riittämätön laimennus voi johtaa hartsin impaatioon. Ennenaikaisilla imeväisillä tai pienipainoisilla imeväisillä voi olla suurentunut riski Kionexin aiheuttamiin ruoansulatuskanavan haittavaikutuksiin. käyttö .
Yliannostus
Yliannostus voi johtaa elektrolyyttihäiriöihin, mukaan lukien hypokalemia, hypokalsemia ja hypomagnesemia. Seerumin elektrolyyttien (kalium, kalsium, magnesium) korjaamiseksi on ryhdyttävä asianmukaisiin toimenpiteisiin, ja hartsi on poistettava ruuansulatuskanavasta käyttämällä asianmukaisia laksatiiveja tai peräruiskeita.
Kionex Kuvaus
Kionex on bentseeni, dietenyylipolymeeri, etenyylibentseenillä sulfonoitu natriumsuola ja sillä on seuraava rakennekaava:
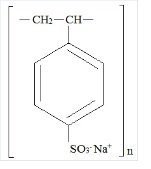
Lääke on kerman- tai vaaleanruskeasta vaaleanruskeaan vaihteleva hienoksi jauhettu, jauhemainen natriumpolystyreenisulfonaatti-muotoinen natriumfosfaatissa valmistettu kationinvaihtohartsi, jonka kationinvaihtokapasiteetti (in-vitro) in vitro -analyysissä on noin 3. Kationinvaihtokapasiteetti on noin 3 %.1 mEq (in vivo noin 1 mEq) kaliumia grammaa kohti. Natriumpitoisuus on noin 100 mg (4,1 mEq) grammaa kohti. Se voidaan antaa suun kautta tai peräruiskeena peräruiskeena.
Yksi gramma Kionexia sisältää 4,1 mEq natriumia.
Kionex – Kliininen farmakologia
Toimintamekanismi
Kionex on imeytymätön, kationinvaihtopolymeeri, joka sisältää natriumin vastinionin.
Kionex lisää kaliumin erittymistä ulosteeseen sitomalla kaliumia maha-suolikanavan luumenissa. Kaliumin sitoutuminen vähentää vapaan kaliumin pitoisuutta ruoansulatuskanavan luumenissa, mikä johtaa seerumin kaliumpitoisuuden alenemiseen. Käytännön vaihtosuhde on 1 mEq K yhtä grammaa hartsia kohti.
Kun hartsi kulkee suolistossa tai jää paksusuoleen peräruiskeen antamisen jälkeen, natriumionit vapautuvat osittain ja korvautuvat kaliumioneilla. Tämä tapahtuu pääasiassa paksusuolessa, joka erittää kaliumioneja enemmän kuin ohutsuoli. Tämän prosessin tehokkuus on rajallinen ja arvaamattomasti vaihteleva.
Farmakodynamiikka
Seerumin kaliumpitoisuuden tehokas aleneminen Kionexin avulla voi kestää tunteja tai päiviä.
Farmakokinetiikka
Natrium-kaliuminvaihtohartsien in vivo -tehokkuus on suunnilleen 33 prosenttia; siten elimistöön kulkeutuu noin kolmannes hartsin todellisesta natriumpitoisuudesta.
Kionex ei imeydy systeemisesti.
Lääkeinteraktiot
In vitro sitoutumistutkimukset osoittivat, että Kionex sitoutui merkittävästi seuraaviin testattuihin lääkeaineisiin – varfariiniin, metoprololiin, fenytoiiniin, furosemidiin, amlodipiiniin ja amoksisilliiniin.
Nonkliininen toksikologia
Karsinogeneesi, mutageenisyys, hedelmällisyyden heikentyminen
Tutkimuksia ei ole tehty.
Valmistustapa/varastointi ja käsittely
Kionex on saatavana kermanruskeasta vaaleanruskeaan vaihtelevana, hienoksi jauhettuna jauheena 1 paunan (454 g) purkeissa, NDC 0574-2004-16.
Varastoidaan 20° – 25°C (68° – 77°F) .
Potilaan neuvontatiedot
Lääkeyhteisvaikutukset
Valvoo potilaita, jotka käyttävät muita suun kautta otettavia lääkkeitä, erottaa Kionexin annostelu vähintään 3 tunnilla (ennen tai jälkeen)
Rx Only
Packaged by
Perrigo
Minneapolis, MN 55427
Tarkistettu 08/2017
PAKKAUS/ETIKETTI PAKKAUSSELOSTE
Rx Only
NDC 0574-2004-16
Kionex®
Kionex®
Natriumpolystyreenisulfonaatti suspensiota varten
Aikuisten aikuisten aikuisannos: 15 g (noin 4 tasaista teelusikallista) yhdestä neljään kertaa päivässä veteen sekoitettuna. Ks. täydelliset lääkemääräystiedot.
Vaikutusta on valvottava huolellisesti määrittämällä seerumin kalium usein 24 tunnin välein. Natriumpitoisuus noin 60 mEq per 15 g.
Suspensio on valmistettava tuoreena eikä sitä saa säilyttää yli 24 tuntia. Annosteltava tiiviisiin, valoa kestäviin astioihin USP:n määritelmän mukaisesti.
VARASTOINTI: Säilytä 20°-25°C (68°-77°F) .
Lue pakkausseloste.
454 grammaa (1 LB)
| Kionex natriumpolystyreenisulfonaattijauhe, suspensiota varten |
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|||||||||||||||||||||
Etiketti – Paddock Laboratories, LLC (967694121)
Lisätietoa Kionexista (natriumpolystyreenisulfonaatti)
- Haittavaikutukset
- Raskauden tai imetyksen aikana
- Ainetietoa annostelusta
- Lääkkeiden yhteisvaikutukset
- En Español
- 4 Arvostelua
- Lääkeluokka:
- FDA-hälytykset (2)
Kuluttajan resurssit
- Potilastiedot
- Kionex (Edistynyt lukeminen)
Ammattilaislähteet
- Reseptitiedot
- Natriumpolystyreenisulfonaatti oraalipulveri (FDA)
Muut tuotemerkit Kayexalate, Kalexate
Seuraavat hoito-ohjeet
- Hyperkalemia
Lääketieteellinen vastuuvapauslauseke