Jotkut atomit ovat poolisempia kuin toiset johtuen siitä, että ne ovat ”ahneempia” elektronien suhteen.
Katsokaa jaksollista järjestelmää, mitä enemmän oikealle ja ylöspäin mennään, sitä elektronegatiivisempia atomeista tulee (jalokaasuja ei lasketa mukaan, koska niillä on täydet kuoret ja ne ovat ”onnellisia” eivätkä tarvitse valenssielektroneita).
Kaikki ovat varmaan kuulleet, että esimerkiksi jauho (F) on yksi elektronegatiivisimmista alkuaineista, se kirjaimellisesti repii elektroneja vety- tai hiiliatomeista. Niin tekee myös kloori (Cl)
Katsokaa tätä kuvaa:
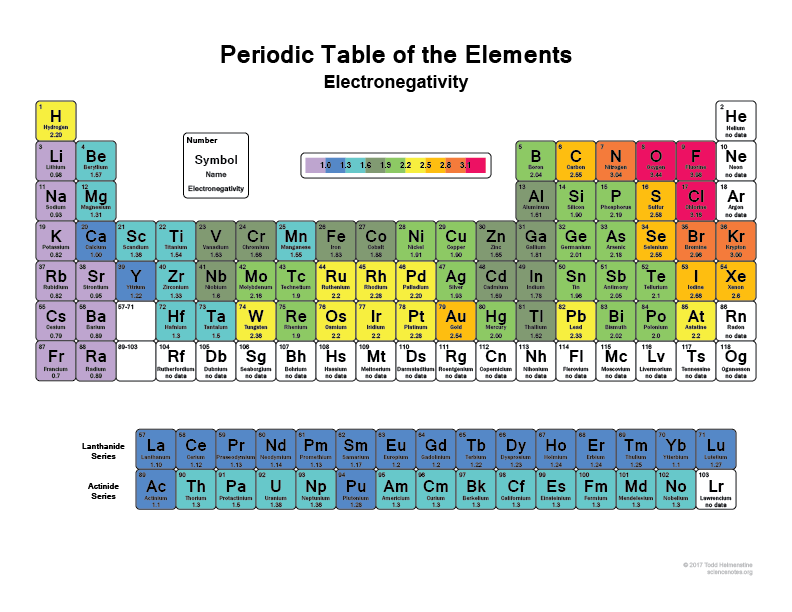
Sentähän se on, miksi sidoksessa joillakin molekyyleillä on superpolaarisia alueita, koska niissä on jotakin kuten vetyä liittymässä johonkin kuten jauhiiniin, joka periaatteessa vain pitää elektronit mukanaan suurimman osan ajasta.
Tämä kysymys voidaan selittää myös ajatuksella elektronipilvistä ja sillä, että elektronegatiivisemmilla atomeilla on yleensä enemmän elektroneja, jotka pysyvät sen kanssa suurimman osan ajasta verrattuna ei niinkään elektronegatiivisiin atomeihin.

Tätä kutsutaan dipolimomentiksi ja menemättä liian pitkälle, näet kuinka suurin osa elektroneista on lähempänä happea kuin vetyä (koska happi on elektronegatiivisempi kuin vety)
Muuten sana elektronegatiivinen kuulostaa toisinaan intuitiiviselta, mutta sana on sähkönegatiivinen positiivisen sijasta, koska kemiassa atomeilla, jotka saavat elektroneja, on negatiivinen etumerkki (Esim. #Cl^-# on kloori, joka on saanut elektronin).