Kemiassa T-muotoinen molekyyligeometria kuvaa joidenkin molekyylien rakenteita, joissa keskeisellä atomilla on kolme ligandia. Tavallisesti kolmikoordinoidut yhdisteet omaksuvat trigonaalisen taso- tai pyramidigeometrian. Esimerkkejä T-muotoisista molekyyleistä ovat halogeenitrifluoridit, kuten ClF3.
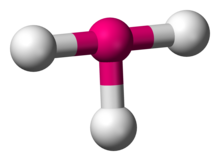
ClF3
C2v
>0

VSEPR-teorian mukaan T-muotoinen geometria syntyy, kun kolme ligandia ja kaksi yksinäistä elektroniparia ovat sitoutuneet keskusatomiin, joka kirjoitetaan AXE-notaatiossa AX3E2. T-muotoinen geometria liittyy AX5-molekyylien trigonaaliseen bipyramidi-molekyyligeometriaan, jossa on kolme ekvatoriaalista ja kaksi aksiaalista ligandia. AX3E2-molekyylissä kaksi yksinäistä paria on kahdessa ekvatoriaalisessa asennossa, ja kolme ligandiatomia on kahdessa aksiaalisessa asennossa sekä yhdessä ekvatoriaalisessa asennossa. Kolme atomia sitoutuvat 90° kulmassa keskiatomin toiselle puolelle, jolloin syntyy T-muoto.
Trifluoroksenaatti(II)anionia, XeF-
3, on tutkittu mahdollisena ensimmäisenä esimerkkinä AX3E3-molekyylistä, jonka VSEPR-järkeilyllä voisi olettaa, että siinä on kuusi elektroniparia oktaedrisessä järjestyksessä, jossa sekä kolme yksinäistä paria että kolme ligandia ovat mer- tai T-muotoisessa asennossa. Vaikka tämä anioni on havaittu kaasufaasissa, synteesiyritykset liuoksessa ja kokeellinen rakenteen määritys eivät ole onnistuneet. Laskennallisen kemian tutkimus osoitti vääristyneen tasomaisen Y-muotoisen geometrian, jossa pienin F-Xe-F-sidoksen kulma on 69° eikä 90° kuten T-muotoisessa geometriassa.