Objectifs d’apprentissage
- Expliquer pourquoi les points d’ébullition des alcools sont plus élevés que ceux des éthers et des alcanes de masses molaires similaires.
- Expliquer pourquoi les alcools et les éthers de quatre atomes de carbone ou moins sont solubles dans l’eau alors que les alcanes comparables ne le sont pas.
Les alcools peuvent être considérés comme des dérivés de l’eau (H2O ; s’écrit aussi HOH).

Comme la liaison H-O-H dans l’eau, la liaison R-O-H est coudée et les molécules d’alcool sont polaires. Cette relation est particulièrement apparente dans les petites molécules et se reflète dans les propriétés physiques et chimiques des alcools de faible masse molaire. Le remplacement d’un atome d’hydrogène d’un alcane par un groupe OH permet aux molécules de s’associer par liaison hydrogène (Figure \(\PageIndex{1}\)).
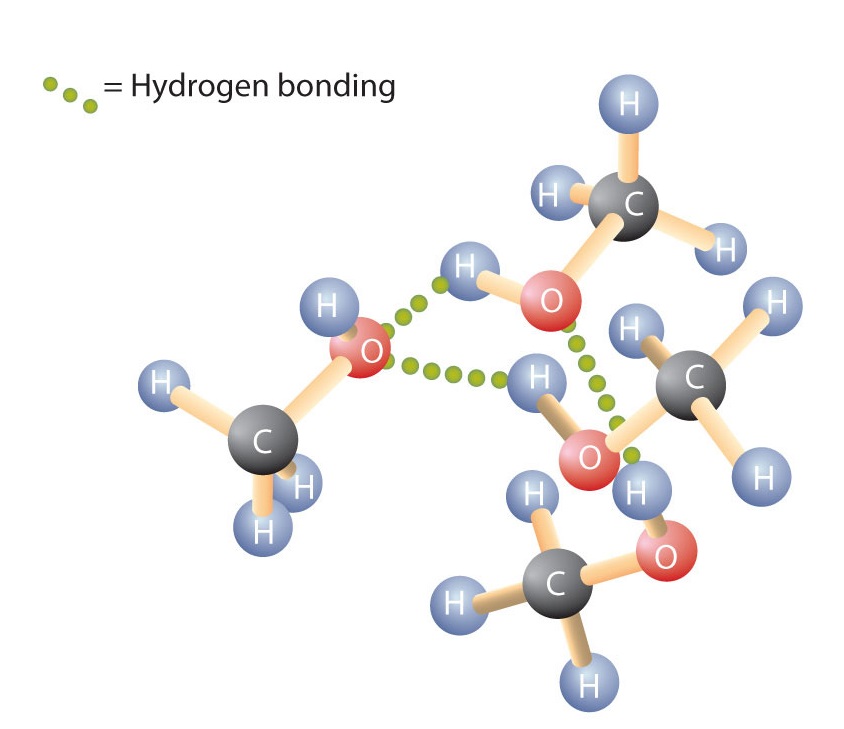
Rappelons que les propriétés physiques sont déterminées en grande partie par le type de forces intermoléculaires. Le tableau \(\PageIndex{1}\) répertorie les masses molaires et les points d’ébullition de certains composés courants. Ce tableau montre que des substances ayant des masses molaires similaires peuvent avoir des points d’ébullition très différents.
| Formule | Nom | Masse molaire | Point d’ébullition (°C) |
|---|---|---|---|
| CH4 | méthane | 16 | -164 |
| HOH | eau | 18 | 100 |
| C2H6 | éthane | 30 | -89 |
| CH3OH | méthanol | 32 | 65 |
| C3H8 | propane | 44 | -42 |
| CH3CH2OH | éthanol | 46 | 78 |
| C4H10 | butane | 58 | -1 |
| CH3CH2CH2OH | 1-propanol | 60 | 97 |
Les alcanes sont non polaires et ne sont donc associés que par des forces de dispersion relativement faibles. Les alcanes ayant de un à quatre atomes de carbone sont des gaz à température ambiante. En revanche, même le méthanol (avec un atome de carbone) est un liquide à température ambiante. La liaison hydrogène augmente considérablement le point d’ébullition des alcools par rapport aux hydrocarbures de masse molaire comparable. Le point d’ébullition est une mesure approximative de la quantité d’énergie nécessaire pour séparer une molécule liquide de ses voisines les plus proches. Si les molécules interagissent par liaison hydrogène, une quantité relativement importante d’énergie doit être fournie pour briser ces attractions intermoléculaires. Ce n’est qu’alors que la molécule peut s’échapper du liquide pour passer à l’état gazeux.
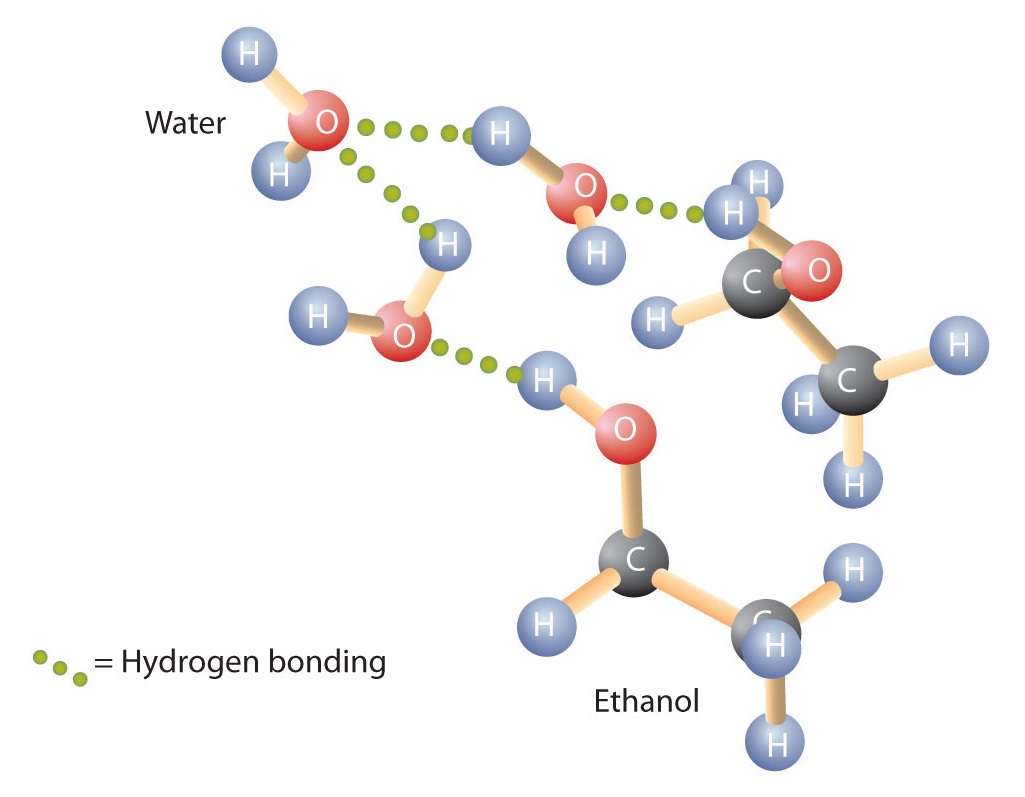
Les alcools peuvent également s’engager dans une liaison hydrogène avec les molécules d’eau (figure \(\PageIndex{2}\)). Ainsi, alors que les hydrocarbures sont insolubles dans l’eau, les alcools comportant un à trois atomes de carbone sont complètement solubles. Cependant, plus la longueur de la chaîne augmente, plus la solubilité des alcools dans l’eau diminue ; les molécules ressemblent davantage à des hydrocarbures et moins à de l’eau. L’alcool 1-décanol (CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2OH) est essentiellement insoluble dans l’eau. Nous constatons fréquemment que la limite de solubilité dans une famille de composés organiques se situe à quatre ou cinq atomes de carbone.
Résumé
Les alcools ont des points d’ébullition plus élevés que les éthers et les alcanes de masses molaires similaires car le groupe OH permet aux molécules d’alcool de s’engager dans une liaison hydrogène. Les alcools de quatre atomes de carbone ou moins sont solubles dans l’eau car les molécules d’alcool s’engagent dans une liaison hydrogène avec les molécules d’eau ; les molécules d’alcanes comparables ne peuvent pas s’engager dans une liaison hydrogène.
Exercices de révision des concepts
-
Pourquoi l’éthanol est-il plus soluble dans l’eau que le 1-hexanol ?
-
Pourquoi le 1-butanol a-t-il un point d’ébullition plus bas que le 1-hexanol ?
Réponses
-
L’éthanol a un groupe OH et seulement 2 atomes de carbone ; le 1-hexanol a un groupe OH pour 6 atomes de carbone et ressemble donc plus à un hydrocarbure (non polaire) que l’éthanol.
-
La masse molaire du 1-hexanol est supérieure à celle du 1-butanol.
Exercices
Répondre aux exercices suivants sans consulter les tableaux du texte.
-
Ranger ces alcools dans l’ordre croissant de leur point d’ébullition : éthanol, méthanol et 1-propanol.
-
Qui a le point d’ébullition le plus élevé : le butane ou le 1-propanol ?
-
Arrangez ces alcools par ordre de solubilité croissante dans l’eau : le 1-butanol, le méthanol et le 1-octanol.
-
Changez ces composés par ordre de solubilité croissante dans l’eau : 1-butanol, éthanol et pentane.
Réponses
-
méthanol< éthanol< 1-propanol
-
1-octanol < 1-butanol <méthanol
.