Réactions chimiques des graisses et des huiles
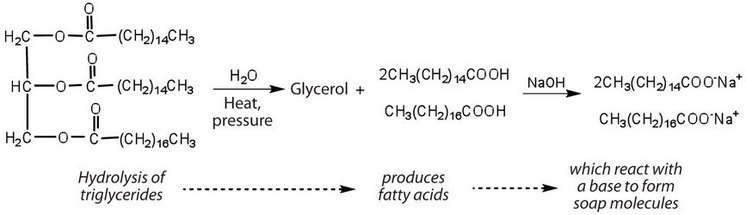
Les graisses et les huiles peuvent participer à une variété de réactions chimiques-par exemple, parce que les triglycérides sont des esters, ils peuvent être hydrolysés en présence d’un acide, d’une base, ou d’enzymes spécifiques connues sous le nom de lipases. L’hydrolyse des graisses et des huiles en présence d’une base est utilisée pour fabriquer du savon et s’appelle la saponification. Aujourd’hui, la plupart des savons sont préparés par hydrolyse des triglycérides (souvent du suif, de l’huile de coco ou des deux) à l’aide d’eau sous haute pression et à haute température. Le carbonate de sodium ou l’hydroxyde de sodium est ensuite utilisé pour convertir les acides gras en leurs sels de sodium (molécules de savon):
Looking Closer : Les savons
Le savon ordinaire est un mélange de sels de sodium de divers acides gras, produit dans l’une des plus anciennes synthèses organiques pratiquées par l’homme (juste après la fermentation des sucres pour produire de l’alcool éthylique). Les Phéniciens (600 avant J.-C.) et les Romains fabriquaient du savon à partir de graisse animale et de cendres de bois. Malgré cela, la production généralisée de savon n’a pas commencé avant les années 1700. Le savon était traditionnellement fabriqué en traitant du saindoux ou du suif fondu avec un léger excès d’alcali dans de grandes cuves ouvertes. Le mélange était chauffé et traversé par des bulles de vapeur. Une fois la saponification terminée, le savon était précipité du mélange par l’ajout de chlorure de sodium (NaCl), éliminé par filtration et lavé plusieurs fois à l’eau. Il est ensuite dissous dans l’eau et reprécipité par l’ajout de NaCl. Le glycérol produit dans la réaction a également été récupéré dans les solutions de lavage aqueuses.
La pierre ponce ou le sable est ajouté pour produire du savon à récurer, tandis que des ingrédients tels que des parfums ou des colorants sont ajoutés pour produire des savons parfumés et colorés. En soufflant de l’air à travers le savon fondu, on obtient un savon flottant. Les savons mous, fabriqués avec des sels de potassium, sont plus chers mais produisent une mousse plus fine et sont plus solubles. Ils sont utilisés dans les savons liquides, les shampooings et les crèmes à raser.
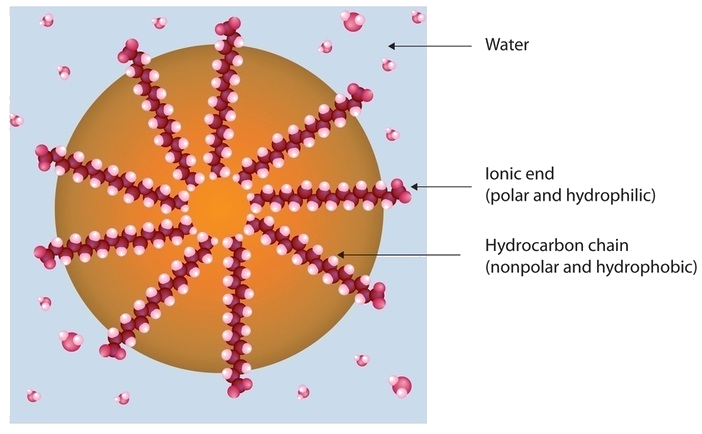
La saleté et la crasse adhèrent généralement à la peau, aux vêtements et à d’autres surfaces en se combinant avec les huiles corporelles, les graisses de cuisson, les graisses de lubrification et d’autres substances similaires qui agissent comme des colles. Comme ces substances ne sont pas miscibles dans l’eau, le lavage à l’eau seule ne suffit pas à les éliminer. Le savon, en revanche, les élimine, car les molécules de savon ont une double nature. Une extrémité, appelée tête, porte une charge ionique (un anion carboxylate) et se dissout donc dans l’eau ; l’autre extrémité, la queue, a une structure hydrocarbonée et se dissout dans les huiles. Les queues d’hydrocarbures se dissolvent dans le sol ; les têtes ioniques restent dans la phase aqueuse, et le savon décompose l’huile en minuscules gouttelettes enfermées dans le savon, appelées micelles, qui se dispersent dans la solution. Les gouttelettes se repoussent mutuellement en raison de leurs surfaces chargées et ne coalescent pas. L’huile ne » collant » plus la saleté à la surface souillée (peau, tissu, plat), la saleté enfermée dans le savon peut être facilement rincée.
Les doubles liaisons dans les graisses et les huiles peuvent subir une hydrogénation et aussi une oxydation. L’hydrogénation des huiles végétales pour produire des graisses semi-solides est un processus important dans l’industrie alimentaire. Chimiquement, il est essentiellement identique à la réaction d’hydrogénation catalytique décrite pour les alcènes.

Dans les procédés commerciaux, le nombre de doubles liaisons qui sont hydrogénées est soigneusement contrôlé pour produire des graisses ayant la consistance souhaitée (molles et souples). Des huiles végétales peu coûteuses et abondantes (canola, maïs, soja) sont ainsi transformées en margarine et en graisses de cuisson. Dans la préparation de la margarine, par exemple, les huiles partiellement hydrogénées sont mélangées à de l’eau, du sel et du lait sec non gras, ainsi qu’à des agents aromatisants, des colorants et des vitamines A et D, qui sont ajoutés pour se rapprocher de l’aspect, du goût et de la valeur nutritive du beurre. (Des conservateurs et des antioxydants sont également ajoutés.) Dans la plupart des beurres de cacahuètes commerciaux, l’huile de cacahuète a été partiellement hydrogénée pour éviter qu’elle ne se sépare. Les consommateurs pourraient diminuer la quantité de graisses saturées dans leur alimentation en utilisant les huiles originales non transformées sur leurs aliments, mais la plupart des gens préfèrent étaler de la margarine sur leurs toasts plutôt que de verser de l’huile dessus.
Beaucoup de gens sont passés du beurre à la margarine ou au shortening végétal parce qu’ils craignent que les graisses animales saturées puissent augmenter le taux de cholestérol sanguin et entraîner l’obstruction des artères. Cependant, lors de l’hydrogénation des huiles végétales, il se produit une réaction d’isomérisation qui produit les acides gras trans mentionnés dans l’essai d’ouverture. Or, des études ont montré que les acides gras trans augmentent également le taux de cholestérol et l’incidence des maladies cardiaques. Les acides gras trans ne présentent pas de courbure dans leur structure, comme c’est le cas des acides gras cis, et sont donc étroitement liés les uns aux autres, comme le sont les acides gras saturés. On conseille maintenant aux consommateurs d’utiliser des huiles polyinsaturées et de la margarine molle ou liquide et de réduire leur consommation totale de graisses à moins de 30% de leur apport calorique total chaque jour.
Les graisses et les huiles qui sont en contact avec l’air humide à température ambiante finissent par subir des réactions d’oxydation et d’hydrolyse qui les font rancir, acquérant une odeur désagréable caractéristique. L’une des causes de cette odeur est la libération d’acides gras volatils par hydrolyse des liaisons ester. Le beurre, par exemple, libère des acides butyrique, caprylique et caprique malodorants. Les micro-organismes présents dans l’air fournissent des lipases qui catalysent ce processus. Le rancissement hydrolytique peut être facilement évité en couvrant la graisse ou l’huile et en la conservant dans un réfrigérateur.
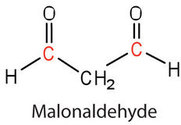
Une autre cause de composés volatils et odorants est l’oxydation des composants d’acides gras insaturés, en particulier l’unité structurelle facilement oxydée

dans les acides gras polyinsaturés, tels que les acides linoléique et linolénique. Un produit particulièrement offensif, formé par le clivage oxydatif des deux doubles liaisons de cette unité, est un composé appelé malonaldéhyde.
Le rancissement est une préoccupation majeure de l’industrie alimentaire, c’est pourquoi les chimistes alimentaires sont toujours à la recherche de nouveaux et meilleurs antioxydants, des substances ajoutées en très petites quantités (0,001%-0,01%) pour empêcher l’oxydation et ainsi supprimer le rancissement. Les antioxydants sont des composés dont l’affinité pour l’oxygène est supérieure à celle des lipides présents dans l’aliment ; ils fonctionnent donc en diminuant de manière préférentielle la quantité d’oxygène absorbée par le produit. Comme la vitamine E a des propriétés antioxydantes, elle contribue à réduire les dommages causés aux lipides dans l’organisme, en particulier aux acides gras insaturés présents dans les lipides des membranes cellulaires.