Entropie
Il existe une tendance dans la nature pour les systèmes à procéder vers un état de plus grand désordre ou d’aléatoire. L’entropie est une mesure du degré d’aléatoire ou de désordre d’un système. L’entropie est un concept facile à comprendre lorsqu’on pense à des situations quotidiennes. L’entropie d’une pièce qui a été récemment nettoyée et rangée est faible. Au fil du temps, elle deviendra probablement plus désordonnée et son entropie augmentera donc (voir la figure ci-dessous). La tendance naturelle d’un système est que son entropie augmente.
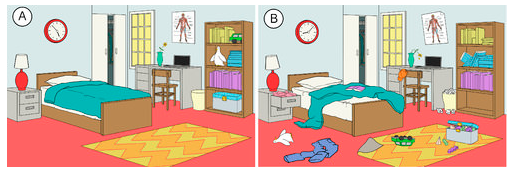
Les réactions chimiques ont également tendance à se dérouler de manière à augmenter l’entropie totale du système. Comment pouvez-vous savoir si une certaine réaction présente une augmentation ou une diminution de l’entropie ? L’état moléculaire des réactifs et des produits fournit certains indices. Les cas généraux ci-dessous illustrent l’entropie au niveau moléculaire.
- Pour une substance donnée, l’entropie de l’état liquide est supérieure à l’entropie de l’état solide. De même, l’entropie du gaz est plus grande que l’entropie du liquide. Par conséquent, l’entropie augmente dans les processus dans lesquels les réactifs solides ou liquides forment des produits gazeux. L’entropie augmente également lorsque des réactifs solides forment des produits liquides.
- L’entropie augmente lorsqu’une substance est décomposée en plusieurs parties. Le processus de dissolution augmente l’entropie parce que les particules de soluté se séparent les unes des autres lorsqu’une solution est formée.
- L’entropie augmente lorsque la température augmente. Une augmentation de la température signifie que les particules de la substance ont une plus grande énergie cinétique. Les particules qui se déplacent plus rapidement ont plus de désordre que les particules qui se déplacent plus lentement à une température plus basse.
- L’entropie augmente généralement dans les réactions dans lesquelles le nombre total de molécules de produits est supérieur au nombre total de molécules de réactifs. Une exception à cette règle est lorsqu’un gaz est produit à partir de réactifs non gazeux.
Les exemples ci-dessous serviront à illustrer comment la variation d’entropie dans une réaction peut être prédite.
\(\ce{Cl_2} \left( g \right) \rightarrow \ce{Cl_2} \left( l\right)\)
L’entropie diminue parce qu’un gaz devient un liquide.
(\ce{CaCO_3} \left( s \right ) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \L’entropie augmente car un gaz est produit et le nombre de molécules augmente. \left( g \right) + 3 \ce{H_2} \left( g \right) \rightarrow 2 \ce{NH_3} \left( g \right)\)
L’entropie diminue parce que quatre molécules réactives totales forment deux molécules de produit totales. Toutes sont des gaz.
\N(\ce{AgNO_3} \left( aq \right) + \ce{NaCl} \left( aq \right) \rightarrow \ce{NaNO_3} \left( aq \right) + \ce{AgCl}
L’entropie diminue parce qu’un solide se forme à partir de réactifs aqueux.
(\ce{H_2} \left( g \right) + \ce{Cl_2} \Ngauche( g \Ndroite) \Nflèche 2 \Nce{HCl}
La variation d’entropie est inconnue (mais probablement pas nulle), car il y a un nombre égal de molécules des deux côtés de l’équation et toutes sont des gaz.