Le modèle atomique
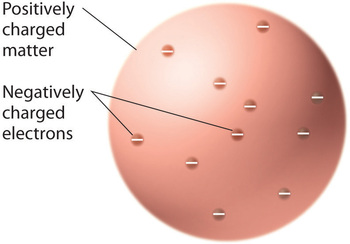
Une fois que les scientifiques ont conclu que toute matière contient des électrons chargés négativement, il est devenu clair que les atomes, qui sont électriquement neutres, doivent également contenir des charges positives pour équilibrer les charges négatives. Thomson a proposé que les électrons soient intégrés dans une sphère uniforme qui contenait à la fois la charge positive et la majeure partie de la masse de l’atome, un peu comme les raisins secs dans le plum-pudding ou les pépites de chocolat dans un cookie (Figure \(\PageIndex{9}\))
2.4.6
Figure \(\PageIndex{9}\) : Modèle de l’atome au pudding aux prunes ou aux biscuits aux pépites de chocolat de Thomson. Dans ce modèle, les électrons sont intégrés dans une sphère uniforme de charge positive. Image utilisée avec permission (CC BY-SA-NC).
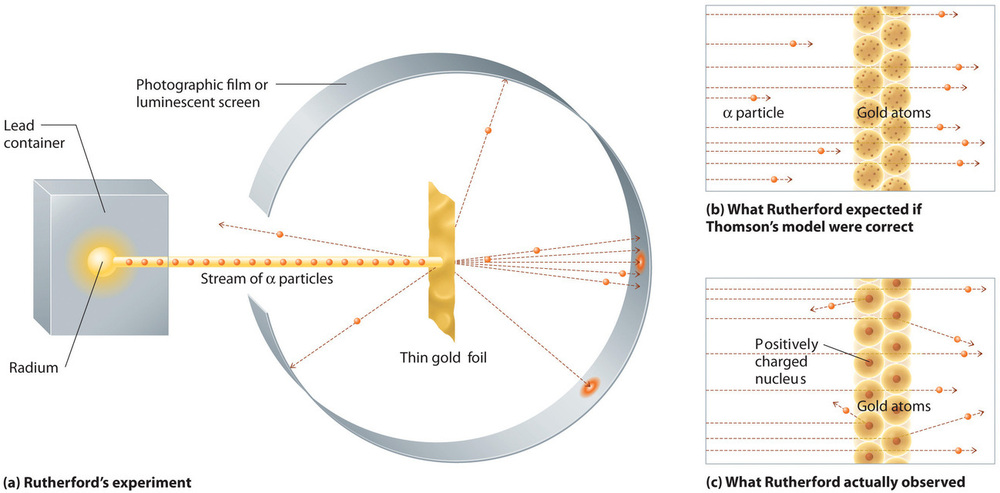
Dans une seule expérience célèbre, cependant, Rutherford a montré sans ambiguïté que le modèle de l’atome de Thomson était incorrect. Rutherford a dirigé un flux de particules α vers une cible en feuille d’or très fine (figure \(\PageIndex{10a}\)) et a examiné comment les particules α étaient diffusées par la feuille. L’or a été choisi parce qu’il pouvait être facilement martelé en feuilles extrêmement fines, minimisant ainsi le nombre d’atomes dans la cible. Si le modèle de l’atome de Thomson était correct, les particules α chargées positivement devraient s’écraser à travers la masse uniformément répartie de la cible en or comme des boulets de canon à travers le côté d’une maison en bois. Elles se déplaçaient peut-être un peu plus lentement lorsqu’elles émergeaient, mais elles devaient essentiellement traverser la cible en ligne droite (Figure \(\PageIndex{10b}\))À la grande surprise de Rutherford, une petite fraction des particules α était déviée à de grands angles, et certaines étaient directement réfléchies vers la source (Figure \(\PageIndex{10c}\)). Selon Rutherford, « C’était presque aussi incroyable que si vous tiriez un obus de 15 pouces sur un morceau de papier de soie et qu’il revenait vous frapper. »
2.4.7
Figure \(\PageIndex{10}\) : Un résumé des expériences de Rutherford. (a) Représentation de l’appareil utilisé par Rutherford pour détecter les déviations dans un flux de particules α visant une cible en feuille d’or mince. Les particules étaient produites par un échantillon de radium. (b) Si le modèle de l’atome de Thomson était correct, les particules α auraient dû traverser directement la feuille d’or. (c) Cependant, un petit nombre de particules α ont été déviées dans diverses directions, y compris vers la source. Cela ne pouvait être vrai que si la charge positive était beaucoup plus massive que la particule α. Il a suggéré que la masse de l’atome d’or est concentrée dans une très petite région de l’espace, qu’il a appelée le noyau. Image utilisée avec permission (CC BY-SA-NC).
Les résultats de Rutherford n’étaient pas compatibles avec un modèle dans lequel la masse et la charge positive sont distribuées uniformément dans tout le volume d’un atome. Au contraire, ils suggéraient fortement que la masse et la charge positive étaient concentrées dans une minuscule fraction du volume d’un atome, que Rutherford appelait le noyau. Il était logique qu’une petite fraction des particules α entre en collision avec les noyaux denses et chargés positivement, soit de façon incidente, ce qui entraîne de grandes déviations, soit presque de front, ce qui fait qu’elles sont réfléchies directement vers la source.
Bien que Rutherford n’ait pas pu expliquer pourquoi les répulsions entre les charges positives dans les noyaux qui contenaient plus d’une charge positive ne provoquaient pas la désintégration du noyau, il a raisonné que les répulsions entre les électrons chargés négativement provoqueraient la distribution uniforme des électrons dans tout le volume de l’atome.On sait aujourd’hui que les forces nucléaires fortes, qui sont beaucoup plus fortes que les interactions électrostatiques, maintiennent les protons et les neutrons ensemble dans le noyau. Pour cette découverte et d’autres, Rutherford a reçu le prix Nobel de chimie en 1908. Malheureusement, Rutherford aurait préféré recevoir le prix Nobel de physique, car il considérait que la physique était supérieure à la chimie. Selon lui, « Toute science est soit de la physique, soit une collection de timbres. »
 2.4.8
2.4.8
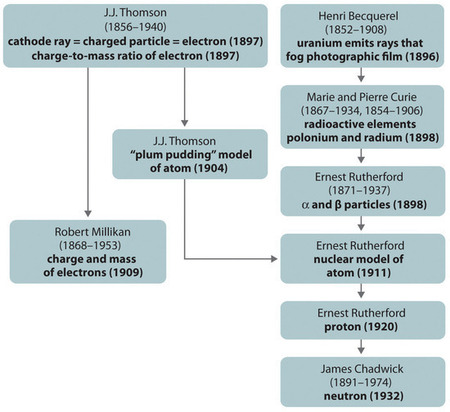
Figure \(\PageIndex{11}\) : Un résumé du développement historique des modèles des composants et de la structure de l’atome. Les dates entre parenthèses correspondent aux années au cours desquelles les expériences clés ont été réalisées. Image utilisée avec autorisation (CC BY-SA-NC).
Le développement historique des différents modèles de la structure de l’atome est résumé dans la (Figure \(\PageIndex{11}\)) Rutherford a établi que le noyau de l’atome d’hydrogène était une particule chargée positivement, pour laquelle il a inventé le nom de proton en 1920. Il a également suggéré que les noyaux des éléments autres que l’hydrogène devaient contenir des particules électriquement neutres ayant approximativement la même masse que le proton. Le neutron, cependant, n’a pas été découvert avant 1932, lorsque James Chadwick (1891-1974, élève de Rutherford ; prix Nobel de physique, 1935) l’a découvert. Grâce aux travaux de Rutherford, il est devenu évident qu’une particule α contient deux protons et des neutrons, et constitue donc le noyau d’un atome d’hélium.
2.4.9
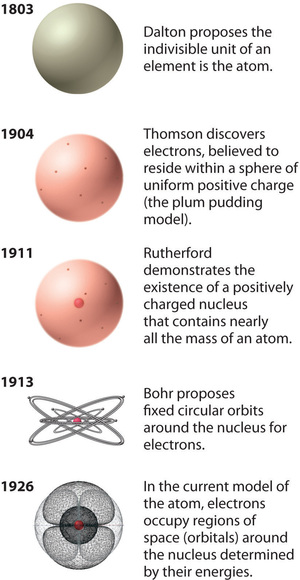
Figure \(\PageIndex{12}\) : L’évolution de la théorie atomique, illustrée par les modèles de l’atome d’oxygène. Le modèle de Bohr et le modèle actuel sont décrits au chapitre 6, « La structure des atomes ». Image utilisée avec permission (CC BY-SA-NC).
Le modèle de l’atome de Rutherford est essentiellement le même que le modèle moderne, sauf qu’on sait maintenant que les électrons ne sont pas distribués uniformément dans le volume d’un atome. Au contraire, ils sont répartis selon un ensemble de principes décrits par la mécanique quantique. La figure \(\PageIndex{12}\) montre comment le modèle de l’atome a évolué au fil du temps, de l’unité indivisible de Dalton à la vision moderne enseignée aujourd’hui.