L’anémie hémolytique auto-immune (AIHA) est médiée par des anticorps, et dans la plupart des cas, l’immunoglobuline (Ig) G est l’anticorps médiateur. Ce type d’AIHA est appelé AIHA « chaud » car les anticorps IgG se fixent mieux à la température du corps. Le SAPI « froid » est médié par les anticorps IgM, qui se fixent au maximum à des températures inférieures à 37°C. Le SHNA causé par une réaction médicamenteuse est rare, avec une incidence annuelle estimée à 1:1 000 000 pour le SHNA grave lié à un médicament.1 Cet article passe en revue la prise en charge des types les plus courants de SHNA, en mettant l’accent sur le SHNA chaud, froid et médicamenteux ; l’évaluation et le diagnostic du SHNA sont examinés dans un article séparé.
Anémie hémolytique auto-immune chaude
Dans le SHNA, l’hémolyse est médiée par des anticorps qui se fixent à la surface des globules rouges. L’AIHA dans laquelle les anticorps IgG sont les anticorps incriminés est appelée AIHA chaude. Le terme « chaud » fait référence au fait que l’anticorps se fixe mieux à la température du corps (37°C). Dans le cas de l’AIHA chaud, les tests révèlent la présence de molécules d’IgG fixées à la surface des globules rouges, et 50 % des patients présentent également des C3. Entre 50 % et 90 % des cas d’AIHA sont dus à des anticorps chauds.2,3 L’incidence de l’AIHA chaud varie selon les séries mais est d’environ 1 cas pour 100 000 patients par an ; cette forme d’hémolyse touche plus fréquemment les femmes que les hommes.4,5
Options thérapeutiques
Première ligne
Stéroïdes. L’objectif de la thérapie dans le cas d’un AIHA chaud peut être difficile à définir. Cependant, la plupart des gens conviennent qu’un hématocrite supérieur à 30 % (ou plus pour prévenir les symptômes) avec une augmentation minimale du nombre de réticulocytes – reflétant un processus hémolytique considérablement ralenti – est un objectif raisonnable. Le traitement initial de l’AIHA chaud est la prednisone à la dose standard de 1 mg/kg par jour (Tableau 1).6,7 Les patients doivent également être mis sous inhibiteurs de la pompe à protons pour prévenir les ulcères. Il faut parfois jusqu’à 3 semaines pour que les patients répondent au traitement par la prednisone. Une fois que l’hématocrite du patient est supérieur à 30 %, la prednisone est lentement diminuée. Bien qu’environ 80 % des patients répondent aux stéroïdes, seuls 30 % d’entre eux peuvent être totalement sevrés de stéroïdes. Pour les patients qui peuvent être maintenus à une dose quotidienne de stéroïdes de 10 mg ou moins, les stéroïdes peuvent être le traitement à long terme le plus raisonnable. En outre, étant donné que l’hémolyse active entraîne une demande accrue d’acide folique, les patients présentant un AIHA chaud se voient souvent prescrire de l’acide folique à raison de 1 mg par jour pour prévenir une anémie mégaloblastique due à une carence en acide folique.
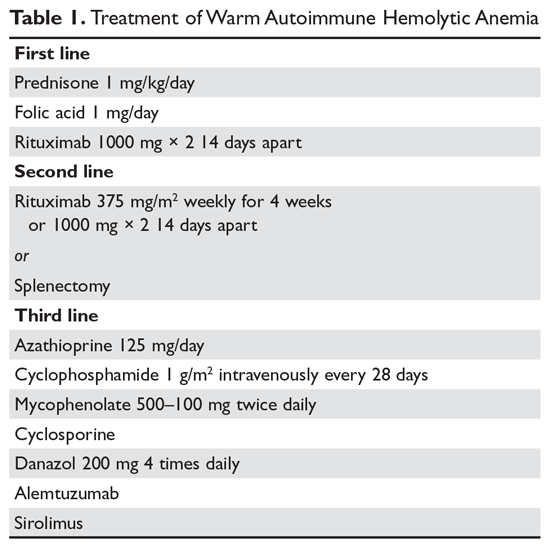
Rituximab. De plus en plus, le traitement par rituximab (anti-CD20) est ajouté aux corticoïdes initiaux. Deux essais cliniques ont montré une augmentation des réponses à long terme et à court terme avec l’utilisation du rituximab.8,9 Une considération importante est que la plupart des patients répondent progressivement au rituximab sur plusieurs semaines, il ne faut donc pas s’attendre à une réponse rapide. La plupart des études ont utilisé la posologie traditionnelle de 375 mg/m2 par semaine pendant 4 semaines. Ces réponses semblent être durables, mais comme dans le cas de la thrombocytopénie immunitaire (PTI), un traitement répété avec le rituximab est efficace.
Les principaux effets secondaires du rituximab sont les réactions à la perfusion, qui sont souvent plus graves avec la première dose. Ces réactions peuvent être contrôlées avec des antihistaminiques, des stéroïdes et, pour les rigueurs sévères, de la mépéridine. Dans de rares cas, les patients peuvent développer une neutropénie (environ 1:500) qui semble être de nature auto-immune. Les infections semblent n’augmenter que très peu avec l’utilisation du rituximab.10 Un groupe à risque est celui des porteurs chroniques du virus de l’hépatite B, qui peuvent subir une réactivation du virus pouvant être fatale. Par conséquent, les patients chez qui l’on envisage d’administrer du rituximab doivent subir un dépistage de l’état de porteur du virus de l’hépatite B.11 Les patients recevant du rituximab courent un très léger risque de leucoencéphalopathie multifocale progressive, qui est plus fréquente chez les patients atteints de cancer et chez les patients fortement immunodéprimés. Le risque global est inconnu mais il est inférieur à 1:50 000.