Autorégulation du débit sanguin cérébral
L’autorégulation du débit sanguin cérébral est la capacité du cerveau à maintenir un débit sanguin relativement constant malgré les changements de pression de perfusion . L’autorégulation est présente dans de nombreux lits vasculaires, mais elle est particulièrement bien développée dans le cerveau, probablement en raison de la nécessité d’un apport sanguin constant et de l’homéostasie de l’eau. Chez les adultes normotendus, le débit sanguin cérébral est maintenu à ~50 ml par 100 g de tissu cérébral par minute, à condition que la PPC soit comprise entre ~60 et 160 mmHg . Au-dessus et en dessous de cette limite, l’autorégulation est perdue et le débit sanguin cérébral devient dépendant de la pression artérielle moyenne de façon linéaire. Lorsque la PPC tombe en dessous de la limite inférieure de l’autorégulation, il s’ensuit une ischémie cérébrale. La réduction du débit sanguin cérébral est compensée par une augmentation de l’extraction d’oxygène du sang. Les signes ou symptômes cliniques de l’ischémie ne sont pas observés avant que la diminution de la perfusion ne dépasse la capacité de l’extraction accrue d’oxygène à répondre aux besoins métaboliques. À ce stade, des signes cliniques d’hypoperfusion apparaissent, notamment des vertiges, une altération de l’état mental et, finalement, des lésions tissulaires irréversibles (infarctus) .
Les mécanismes d’autorégulation dans le cerveau ne sont pas complètement compris et diffèrent probablement en cas d’augmentation ou de diminution de la pression. Bien que le rôle de l’implication neuronale dans l’autorégulation soit séduisant, des études ont montré que l’autorégulation du débit sanguin cérébral est préservée chez les animaux dénervés sur le plan sympathique et parasympathique, ce qui indique qu’une contribution majeure des facteurs neurogènes extrinsèques à l’autorégulation du débit sanguin cérébral est peu probable (voir Innervation périvasculaire). Récemment, un rôle de l’oxyde nitrique neuronal dans la modulation de l’autorégulation du débit sanguin cérébral a été démontré, ce qui suggère que, bien que l’innervation extrinsèque ne soit pas impliquée, l’innervation intrinsèque peut jouer un rôle. On a également proposé que les biproduits du métabolisme jouent un rôle dans l’autorégulation. La réduction du débit sanguin cérébral stimule la libération de substances vasoactives par le cerveau, qui provoquent la dilatation des artères. Les candidats à ces substances vasoactives comprennent H+, K+, O2, l’adénosine et d’autres. L’autorégulation du débit sanguin cérébral lorsque la pression fluctue à l’extrémité supérieure de la courbe autorégulatrice est très probablement due au comportement myogénique des muscles lisses cérébraux qui se contractent en réponse à une pression élevée et se dilatent en réponse à une pression réduite. La contribution importante de l’activité myogénique à l’autorégulation est démontrée in vitro dans des artères cérébrales isolées et pressurisées qui se contractent en réponse à une pression élevée et se dilatent en réponse à une pression réduite (voir Réponse myogénique). L’autorégulation à des pressions inférieures à la gamme de pressions myogéniques implique probablement l’hypoxie et la libération de facteurs métaboliques .
L’importance de l’autorégulation dans la fonction cérébrale normale est soulignée par le fait que des lésions cérébrales importantes se produisent lorsque les mécanismes d’autorégulation sont perdus. Par exemple, lors d’une hypertension aiguë à des pressions supérieures à la limite d’autorégulation, la constriction myogénique du muscle lisse vasculaire est vaincue par la pression intravasculaire excessive et une dilatation forcée des vaisseaux cérébraux se produit . La perte du tonus myogénique pendant la dilatation forcée diminue la résistance cérébrovasculaire, un résultat qui peut produire une forte augmentation du débit sanguin cérébral (300-400%), connue sous le nom de percée autorégulatrice (Figure 16). En outre, la diminution de la résistance cérébrovasculaire augmente la pression hydrostatique sur l’endothélium cérébral, provoquant la formation d’œdèmes , la cause sous-jacente de conditions telles que l’encéphalopathie hypertensive, le syndrome d’encéphalopathie réversible postérieure (PRES) et l’éclampsie (voir Formation d’œdèmes vasogènes).
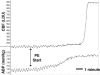
FIGURE 16
Traçage du CBF (en unités Doppler laser) et de l’ABP (en mmHg) en réponse à des doses croissantes de PE. Dans cette expérience, le CBF a augmenté quatre fois plus que la ligne de base lorsque l’ABP a augmenté de 140 à 210 mmHg, démontrant une percée autorégulatrice. Utilisé (suite…)
Bien que peu fréquente depuis l’avènement d’un traitement antihypertenseur efficace, l’encéphalopathie hypertensive survient à la suite d’une augmentation soudaine et soutenue de la pression artérielle suffisante pour dépasser la limite supérieure de l’autorégulation du débit sanguin cérébral (>160 mmHg) . Les premières études sur la réaction des vaisseaux cérébraux à une pression sanguine élevée ont donné naissance au concept de vasospasme hypertensif. L’encéphalopathie hypertensive aiguë était considérée comme le résultat d’un spasme – défini comme une vasoconstriction incontrôlée – des artères cérébrales, provoquant une ischémie du tissu cérébral. Ce concept est né des observations de Byrom qui a produit une hypertension rénale expérimentale et a constaté que ~90% des rats hypertendus présentant des manifestations neurologiques présentaient de multiples taches corticales d’extravasation de bleu trypan, alors que les rats sans symptômes cérébraux semblaient avoir une perméabilité cérébrovasculaire normale. Il a également noté ce qu’il a appelé une alternance de vasoconstriction/vasodilatation dans les vaisseaux pial, un phénomène connu sous le nom de « cordon de saucisse ». Cette observation l’a amené à conclure que le vasospasme cérébral provoquait l’ischémie et la formation d’un œdème en réponse à une hypertension aiguë. Byrom a par la suite modifié son point de vue et s’est référé à une observation faite dans la circulation mésentérique, selon laquelle les vaisseaux présentant cet aspect en « cordon de saucisse » présentaient une fuite de protéines uniquement dans les parties dilatées des vaisseaux. Depuis lors, il a été établi que l’hypertension artérielle entraîne une augmentation du débit sanguin cérébral et une « rupture de l’autorégulation ». D’autres expériences ont confirmé que la perte de la vasoconstriction myogénique pendant la dilatation forcée, plutôt que le spasme, est l’événement critique de l’encéphalopathie hypertensive .