L’élément chimique hélium est classé comme un gaz noble et un non-métal. Il a été découvert en 1895 par William Ramsay.

Zone de données
| Classification : | L’hélium est un gaz noble et un non-métal |
| Couleur: | incolore |
| Poids atomique: | 4.00260 |
| Etat: | gazeux |
| Point de fusion: | -272,2 oC, 0,95 K |
| Note : A la pression atmosphérique normale, l’hélium ne se solidifie pas et n’a donc pas de point de fusion. Le point de fusion cité ci-dessus est sous une pression de 25 atmosphères. | |
| Point d’ébullition: | -268,9 oC, 4.2 K |
| Électrons: | 2 |
| Protons: | 2 |
| Neutrons dans l’isotope le plus abondant : | 2 |
| Ecoquilles électroniques: | 2 |
| Configuration électronique: | 1s2 |
| Densité à 20oC: | 0.0001787 g/cm3 |
Afficher plus, y compris : Chaleur, énergies, oxydation,
réactions, composés, rayons, conductivités
| Volume atomique: | 27,2 cm3/mol |
| Structure: | généralement hexagonale serrée |
| (v.haute pression nécessaire pour solidifier l’hélium) | |
| Capacité thermique spécifique | 5,193 J g-1 K-1 |
| Chaleur de fusion | 0.0138 kJ mol-1 |
| Chaleur d’atomisation | 0 |
| Chaleur de vaporisation | 0.0845 kJ mol-1 |
| Première énergie d’ionisation | 2372.3 kJ mol-1 |
| 2ème énergie d’ionisation | – |
| 3ème énergie d’ionisation | – |
| Affinité électronique | 0 kJ mol-1 |
| Nombre minimal d’oxydation | 0 |
| Min. commun d’oxydation | 0 |
| Nombre maximum d’oxydation | 0 |
| Nombre maximum d’oxydation commun. | 0 |
| Electronégativité (échelle de Pauling) | – |
| Volume de polarisabilité | 0.198 Å3 |
| Réaction avec l’air | aucune |
| Réaction avec 15 M HNO3 | aucune |
| Réaction avec 6 M HCl | aucun |
| Réaction avec 6 M NaOH | aucun |
| Oxyde(s) | aucun |
| Hydrure(s) | néant |
| Chlorure(s) | néant |
| Rayon atomique | 31 pm |
| Rayon ionique (ion 1+) | – |
| Rayon ionique (2+ ion) | – |
| Rayon ionique (3+ ion) | – |
| Rayon ionique (1- ion) | – |
| Rayon ionique (2- ion) | – |
| Rayon ionique (3- ion) | – |
| Conductivité thermique | 0.15 W m-1 K-1 |
| Conductivité électrique | – |
| Point de congélation/fusion : | -272,2 oC, 0.95 K |

Nasa : Les atomes d’hélium ionisés à environ 60 000 °C dans la chromosphère du Soleil émettent la lumière ultraviolette vue sur cette image.
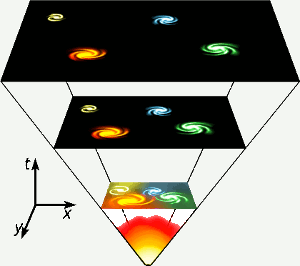
L’hélium a été fabriqué au cours des trois premières minutes d’existence de l’univers, lorsque les températures étaient partout suffisamment élevées pour que la fusion nucléaire se produise. Cette courte phase à haute énergie est représentée tout en bas du diagramme. L’hélium est également produit par la fusion nucléaire de l’hydrogène dans les étoiles comme la nôtre. Image : Gnixon
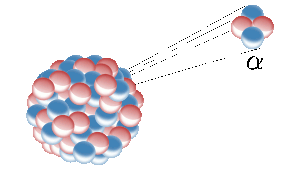
L’hélium sur terre provient de la fission nucléaire d’éléments radioactifs comme l’uranium. Ici, un noyau radioactif émet un noyau d’hélium (également appelé particule alpha). Image : Inductiveload

Spectre de l’hélium avec une ligne jaune proéminente. Image : Nasa

William Ramsay montrant la dernière colonne du tableau périodique contenant les gaz nobles (ou inertes). Ramsay a reçu le prix Nobel de chimie en 1904 pour son travail de découverte des gaz inertes. Image : Vanity Fair
Découverte de l’hélium
L’histoire de la découverte de l’hélium est imbriquée avec la découverte de la nature des étoiles.
A une époque, les gens croyaient que nous ne saurions jamais de quoi sont faites les étoiles. En 1835, le philosophe français Auguste Comte déclarait : « nous ne pourrons jamais, par aucun moyen, étudier leur composition chimique. » (1)
Comte pensait que nous ne pourrions apprendre ce qu’était la matière des étoiles que si nous pouvions la faire entrer dans le laboratoire.
Malgré le pessimisme de Comte, la méthode de découverte de l’hélium et des compositions des étoiles avait déjà été trouvée. En 1814, le physicien allemand Joseph Fraunhofer avait repris la méthode d’Isaac Newton pour diviser la lumière du soleil à l’aide d’un prisme et avait fait une avancée cruciale. Fraunhofer avait remarqué des lignes sombres dans l’arc-en-ciel de couleurs provenant de la lumière du soleil divisée par un prisme ; les lignes qu’il a vues ont été la toute première observation du spectre d’une étoile. (2), (3)
En 1859/60, les scientifiques allemands Gustav Kirchhoff et Robert Bunsen ont fait d’énormes progrès dans la science de la spectroscopie, notamment en découvrant que les lignes sombres que Fraunhofer avait vues étaient comme l’empreinte digitale d’une substance.
Le décor était planté pour que Kirchhoff et Bunsen découvrent de nouveaux éléments en étudiant la lumière des substances lorsqu’elles brûlent.
En 1860, ils ont découvert le césium par ses lignes spectrales bleues et en 1861 le rubidium à partir de deux lignes spectrales rouges. Puis William Crookes a découvert le thallium en 1861 après avoir observé une ligne spectrale verte brillante.
Kirchhoff et Bunsen ont examiné le spectre du soleil et ont pu conclure que le fer était présent dans son atmosphère incandescente. (4)
Pour la découverte de l’hélium, quelques années supplémentaires ont été nécessaires. En août 1868, la première éclipse totale depuis la publication des travaux de Kirchhoff et Bunsen était attendue.
L’astronome français Pierre Janssen attendait une éclipse afin d’observer des proéminences dans la couronne solaire à l’aide d’un spectroscope. Dans les deux semaines qui ont suivi l’éclipse, Janssen a mis au point une méthode permettant d’enregistrer les spectres des prominences sans avoir besoin d’une éclipse. Dans ces spectres, il a observé une ligne jaune. (5)
La ligne était dans une position similaire mais non identique aux lignes du spectre du sodium. On les a appelées les lignes D1 et D2. Le scientifique anglais Norman Lockyer a étudié la nouvelle raie jaune ; plus tard, elle sera appelée la raie D3.Il a publié son étude de la raie, conscient qu’elle pourrait être causée par un nouvel élément:
« …alors nous savions que nous n’avions pas affaire à l’hydrogène ; donc nous devions faire avec un élément que nous ne pouvions pas obtenir dans nos laboratoires, et donc j’ai pris sur moi la responsabilité de forger le mot hélium, en premier lieu pour l’utilisation en laboratoire. » (6)
Le nom hélium venait du mot grec désignant le soleil, helios.
Lockyer et Edward Frankland, son collègue, avaient un certain nombre d’autres idées sur les causes possibles de la ligne jaune et n’ont donc pas annoncé un nouvel élément.
En 1871, d’autres scientifiques étaient au courant de la situation. Lord Kelvin a discuté de la « réflexion de la lumière de l’hydrogène et de l »hélium’ incandescents autour du soleil ». L’utilisation d' »hélium » est suivie d’une note de bas de page pour l’expliquer:
« Frankland et Lockyer trouvent que les proéminences jaunes donnent une ligne brillante très décidée non loin de D, mais jusqu’à présent non identifiée avec une flamme terrestre. Elle semble indiquer une nouvelle substance, qu’ils proposent d’appeler Hélium. » (7)
L’existence de l’Hélium n’était cependant pas acceptée par tous. (5)
Tous les doutes ont été dissipés lorsque le chimiste écossais William Ramsay a isolé l’hélium en 1895 à Londres. Ramsay avait codécouvert l’argon en 1894 ; l’argon était le premier des gaz nobles à être découvert. En 1895, il lit un article de William Hillebrand décrivant un gaz non réactif libéré lorsqu’on ajoute de l’acide au minéral uranium, l’uranite. Hillebrand pensait que ce gaz était de l’azote.
Ramsay, qui pensait que le gaz pouvait contenir de l’argon, a répété l’expérience de Hillebrand en utilisant un autre minéral d’uranium, la clévéite, et a recueilli le gaz.
Son spectroscope indiqua la présence d’azote, d’argon et d’un autre gaz. Ramsay a soupçonné qu’il pouvait s’agir d’hélium, car il semblait y avoir une raie D3. (8) Sachant que Lockyer et William Crookes avaient un meilleur spectroscope que le sien, il leur envoya un échantillon du gaz. Malheureusement, l’échantillon ne convenait pas, Lockyer a donc obtenu un échantillon d’uranite, a extrait le gaz et l’a étudié au spectroscope. Il écrit : (8)
« Une par une, les lignes inconnues que j’avais observées dans le soleil en 1868 se sont révélées appartenir au gaz. »
Le spectre du gaz était identique à celui de l' »hélium » du soleil. Un nouvel élément gagnait sa place dans le tableau périodique.
Visitez la page de faits sur l’hélium cool de Chemicool.

Apparence et caractéristiques
Effets nocifs :
L’hélium n’est pas connu pour être toxique.
Caractéristiques :
L’hélium est un gaz monatomique léger, inodore, incolore et inerte. Il peut former des molécules diatomiques, mais seulement faiblement et à des températures proches du zéro absolu.
L’hélium a le plus bas point de fusion de tous les éléments et son point d’ébullition est proche du zéro absolu.
Contrairement à tout autre élément, l’hélium ne se solidifie pas mais reste liquide jusqu’au zéro absolu (0 K) sous des pressions ordinaires.
La voix de quelqu’un qui a inhalé temporairement de l’hélium a un son aigu.
Utilisations de l’hélium
L’imagerie par résonance magnétique (IRM) est le plus gros utilisateur d’hélium. L’hélium est utilisé pour refroidir les aimants supraconducteurs des scanners IRM.
L’hélium est utilisé pour remplir les ballons (dirigeables) et pour pressuriser les fusées à combustible liquide.
Des mélanges d’hélium et d’oxygène sont utilisés comme « air » artificiel pour les plongeurs et autres personnes travaillant sous pression. L’hélium est utilisé à la place de l’azote de l’air normal car, après une longue plongée, l’hélium quitte le corps plus rapidement que l’azote, ce qui permet une décompression plus rapide.
L’hélium est utilisé comme un écran gazeux à proximité de la soudure à l’arc empêchant, par exemple, toute réaction des soudures métalliques chaudes avec l’oxygène. Ce gaz est utilisé dans l’industrie des semi-conducteurs pour fournir une atmosphère inerte pour la croissance des cristaux de silicium et de germanium. Il est également utilisé comme gaz à haute température dans la production de titane et de zirconium, et comme gaz porteur en chromatographie en phase gazeuse.
Abondance et isotopes
Abondance croûte terrestre : 8 parties par milliard en poids, 43 parties par milliard en moles
Abondance système solaire : 23 % en poids, 7,4 % en moles
Coût, pur : 5,2 $ par 100g
Coût, en vrac : $ par 100g
Source : La quasi-totalité de l’hélium sur Terre est le résultat de la désintégration radioactive. Les principales sources d’hélium proviennent des gisements de gaz naturel dans les puits du Texas, de l’Oklahoma et du Kansas. L’hélium est extrait par distillation fractionnée du gaz naturel, qui contient jusqu’à 7% d’hélium.
Isotopes : L’hélium possède 8 isotopes dont les demi-vies sont connues, avec des numéros de masse de 3 à 10. L’hélium naturel est un mélange de ses deux isotopes stables, 3He et 4He avec des abondances naturelles de 0,0001% et 99,999% respectivement.

- Auguste Comte, Cours de Philosophie Positive at Project Gutenberg
- Keith J. Laidler, The World of Physical Chemistry, 1993, p179.
- L’ère de la spectroscopie classique, de MIT Spectroscopy.
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics, 1984, Elsevier Science Publishers, p211
- Helge Kragh, The Solar Element : Une reconsidération de l’histoire primitive de l’hélium., 2009, Annals of Science, 66:2, p157-182.
- J. Norman Lockyer, La croissance de nos connaissances sur l’hélium., Science Progress, 1896, Vol 5., p249
- W. Thomson, discours présidentiel, Association britannique pour le progrès de la science, 1871, (discours. XCIX).
- Sir Norman Lockyer, La place du soleil dans la nature…, 1897, p47-48
Citer cette page
Pour un lien en ligne, veuillez copier et coller l’un des éléments suivants :
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
ou
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
Pour citer cette page dans un document académique, veuillez utiliser la citation conforme à la norme MLA suivante :
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.
.