En chimie, la géométrie moléculaire en T décrit les structures de certaines molécules où un atome central possède trois ligands. Ordinairement, les composés à trois coordinations adoptent des géométries planes trigonales ou pyramidales. Des exemples de molécules en forme de T sont les trifluorures d’halogène, tels que ClF3.
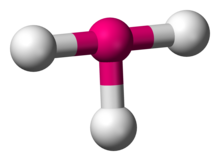
ClF3
C2v
90°, 180°
>0

Selon la théorie VSEPR, la géométrie en T résulte lorsque trois ligands et deux paires d’électrons solitaires sont liés à l’atome central, écrit en notation AXE sous la forme AX3E2. La géométrie en forme de T est liée à la géométrie moléculaire bipyramidale trigonale pour les molécules AX5 avec trois ligands équatoriaux et deux ligands axiaux. Dans une molécule AX3E2, les deux paires solitaires occupent deux positions équatoriales, et les trois atomes du ligand occupent les deux positions axiales ainsi qu’une position équatoriale. Les trois atomes se lient à des angles de 90° sur un côté de l’atome central, produisant la forme en T.
L’anion trifluoroxénate(II), XeF-
3, a été étudié comme un premier exemple possible d’une molécule AX3E3, qui pourrait être attendu par le raisonnement VSEPR pour avoir six paires d’électrons dans un arrangement octaédrique avec à la fois les trois paires solitaires et les trois ligands dans une orientation en mer ou en T. Bien que cet anion ait été détecté en phase gazeuse, les tentatives de synthèse en solution et de détermination expérimentale de la structure n’ont pas abouti. Une étude de chimie computationnelle a montré une géométrie plane déformée en forme de Y avec le plus petit angle de liaison F-Xe-F égal à 69°, plutôt que 90° comme dans une géométrie en forme de T.
.