Nom générique : polystyrène sulfonate de sodium
Formation posologique : suspension orale / rectale
Médicament revu par Drugs.com. Dernière mise à jour le 22 juillet 2020.
- Aperçu
- Effets secondaires
- Dosage
- Professionnel
- Interactions
- Plus
- Indications et utilisation de Kionex
- Dosage et administration de Kionex
- Informations générales
- Dose recommandée
- Préparation et administration
- Formes posologiques et dosages
- Contre-indications
- Avertissements et précautions
- Nécrose intestinale
- Dérèglements électrolytiques
- Surcharge liquidienne chez les patients sensibles à un apport élevé en sodium
- Risque d’aspiration
- La liaison à d’autres médicaments administrés par voie orale
- Réactions indésirables
- Interactions médicamenteuses
- Interactions générales
- Antiacides donneurs de cations
- Sorbitol
- Utilisation dans des populations particulières
- Grossesse
- Lactation
- Utilisation pédiatrique
- Surdosage
- Kionex Description
- Kionex – Pharmacologie clinique
- Mécanisme d’action
- Pharmacodynamique
- Pharmacocinétique
- Toxicologie non clinique
- Carcinogenèse, mutagenèse, altération de la fertilité
- Mode de fourniture/stockage et manipulation
- Informations destinées aux patients
- Emballage/Enveloppe principale
- Plus d’informations sur Kionex (polystyrène sulfonate de sodium)
- Ressources pour les consommateurs
- Ressources professionnelles
- Guides de traitement associés
Indications et utilisation de Kionex
Kionexis indiqué dans le traitement de l’hyperkaliémie.
Limitation d’utilisation :
Kionex ne doit pas être utilisé comme traitement d’urgence de l’hyperkaliémie menaçant le pronostic vital en raison de son délai d’action .
Dosage et administration de Kionex
Informations générales
Administrer Kionex au moins 3 heures avant ou 3 heures après d’autres médicaments oraux. Les patients souffrant de gastroparésie peuvent nécessiter une séparation de 6 heures
Dose recommandée
L’intensité et la durée du traitement dépendent de la sévérité et de la résistance de l’hyperkaliémie.
Oral
La dose quotidienne totale moyenne de Kionex chez l’adulte est de 15 g à 60 g, administrée en dose de 15 g (quatre cuillères à café rases), une à quatre fois par jour.
Rectal
La dose moyenne chez l’adulte est de 30 g à 50 g toutes les six heures.
Préparation et administration
Préparation de la suspension fraîche et utilisation dans les 24 heures.
Ne pas chauffer Kionex car cela pourrait altérer les propriétés d’échange de la résine.
Une cuillère à café rase contient environ 3,5 g de Kionex et 15 mEq de sodium.
Suspension buccale
Suspendre chaque dose dans une petite quantité d’eau ou de sirop, environ 3 à 4 ml de liquide par gramme de résine. Administrer avec le patient en position verticale.
Lavement
Après un lavement initial de nettoyage, insérer un tube en caoutchouc souple de grande taille (French 28) dans le rectum sur une distance d’environ 20 cm, avec l’extrémité bien dans le côlon sigmoïde, et le scotcher en place.
Administrer sous forme d’émulsion chaude (température corporelle) dans 100 ml de véhicule aqueux et rincer avec 50 à 100 ml de liquide. Une suspension un peu plus épaisse peut être utilisée, mais ne pas former de pâte.
Agiter doucement l’émulsion pendant l’administration. La résine doit être retenue aussi longtemps que possible et suivie d’un lavement de nettoyage avec une solution ne contenant pas de sodium. S’assurer qu’un volume adéquat de solution nettoyante (jusqu’à 2 litres) est utilisé.
Formes posologiques et dosages
Kionex est une poudre crème à brun clair, finement broyée et est disponible en pots de 454 g.
Contre-indications
Kionex est contre-indiqué chez les patients présentant les conditions suivantes :
– Hypersensibilité aux résines de polystyrène sulfonate – Maladie intestinale obstructive – Nouveau-nés présentant une motilité intestinale réduite
Avertissements et précautions
Nécrose intestinale
Des cas de nécrose intestinale, dont certains mortels, et d’autres effets indésirables gastro-intestinaux graves (hémorragie, colite ischémique, perforation) ont été rapportés en association avec l’utilisation de Kionex. La majorité de ces cas ont rapporté l’utilisation concomitante de sorbitol. Des facteurs de risque d’effets indésirables gastro-intestinaux étaient présents dans de nombreux cas, notamment la prématurité, des antécédents de maladie ou de chirurgie intestinale, l’hypovolémie, ainsi que l’insuffisance et la défaillance rénale. L’administration concomitante de sorbitol n’est pas recommandée.
– Utiliser uniquement chez les patients ayant une fonction intestinale normale. Éviter l’utilisation chez les patients qui n’ont pas eu de selles après une intervention chirurgicale. – Éviter l’utilisation chez les patients qui présentent un risque de constipation ou d’impaction (y compris ceux ayant des antécédents d’impaction, de constipation chronique, de maladie inflammatoire de l’intestin, de colite ischémique, d’athérosclérose intestinale vasculaire, de résection intestinale antérieure ou d’obstruction intestinale). Cesser l’utilisation chez les patients qui développent une constipation.
Dérèglements électrolytiques
Surveiller le potassium sérique pendant le traitement car une hypokaliémie sévère peut survenir.
Kionex n’est pas totalement sélectif du potassium et de petites quantités d’autres cations tels que le magnésium et le calcium peuvent également être perdues pendant le traitement. Surveillez le calcium et le magnésium chez les patients recevant Kionex.
Surcharge liquidienne chez les patients sensibles à un apport élevé en sodium
Chaque dose de 15 g de Kionex contient 1500 mg (60 mEq) de sodium. Surveiller les patients sensibles à l’apport en sodium (insuffisance cardiaque, hypertension, œdème) pour détecter des signes de surcharge liquidienne. Un ajustement des autres sources de sodium peut être nécessaire.
Risque d’aspiration
Des cas de bronchite aiguë ou de bronchopneumonie causés par l’inhalation de particules de polystyrène sulfonate de sodium ont été rapportés. Les patients dont le réflexe nauséeux est altéré, dont l’état de conscience est altéré, ou les patients sujets à des régurgitations peuvent présenter un risque accru. Administrer Kionex avec le patient en position verticale.
La liaison à d’autres médicaments administrés par voie orale
Kionex peut se lier à des médicaments administrés par voie orale, ce qui pourrait diminuer leur absorption gastro-intestinale et conduire à une efficacité réduite. Administrer les autres médicaments administrés par voie orale au moins 3 heures avant ou 3 heures après Kionex. Les patients souffrant de gastroparésie peuvent nécessiter une séparation de 6 heures. .
Réactions indésirables
Les réactions indésirables suivantes sont discutées ailleurs dans l’étiquetage :
– Nécrose intestinale – Perturbations électrolytiques – Aspiration
Les réactions indésirables suivantes ont été identifiées lors de l’utilisation post-approbation de Kionex. Comme ces réactions sont rapportées volontairement par une population de taille incertaine, il n’est pas toujours possible d’estimer leur fréquence de manière fiable ou d’établir une relation de cause à effet avec l’exposition au médicament.
Gastro-intestinal : anorexie, constipation, diarrhée, fécalome, concrétions gastro-intestinales (bézoards), colite ischémique, nausées, ulcérations, vomissements, irritation gastrique, obstruction intestinale (due à la concentration d’hydroxyde d’aluminium)
Métabolique : alcalose systémique
Interactions médicamenteuses
Interactions générales
Aucune étude formelle d’interaction médicamenteuse n’a été réalisée chez l’homme.
Kionex a le potentiel de se lier à d’autres médicaments. Dans les études de liaison in vitro, il a été montré que Kionex se lie de manière significative aux médicaments oraux (n=6) qui ont été testés. Une diminution de l’absorption du lithium et de la thyroxine a également été rapportée lors de l’administration simultanée de Kionex. La liaison de Kionex à d’autres médicaments oraux pourrait entraîner une diminution de l’absorption gastro-intestinale et une perte d’efficacité en cas de prise proche de l’administration de Kionex. Administrer Kionex au moins 3 heures avant ou 3 heures après la prise d’autres médicaments oraux. Les patients souffrant de gastroparésie peuvent nécessiter une séparation de 6 heures. Surveiller la réponse clinique et/ou les taux sanguins lorsque cela est possible.
Antiacides donneurs de cations
L’administration orale simultanée de Kionex avec des antiacides donneurs de cations non absorbables et des laxatifs peut réduire la capacité d’échange de potassium de la résine et augmenter le risque d’alcalose systémique.
Sorbitol
Le sorbitol peut contribuer au risque de nécrose intestinale et son utilisation concomitante n’est pas recommandée.
Utilisation dans des populations particulières
Grossesse
Résumé des risques
Kionex n’est pas absorbé par voie systémique après administration orale ou rectale et l’utilisation maternelle ne devrait pas entraîner de risque ftal.
Lactation
Résumé des risques
Kionex n’est pas absorbé par voie systémique par la mère, l’allaitement ne devrait donc pas entraîner de risque pour le nourrisson.
Utilisation pédiatrique
Les études de sécurité et d’efficacité n’ont pas été menées chez les patients pédiatriques.
Chez les patients pédiatriques, comme chez les adultes, Kionex devrait fixer le potassium au ratio d’échange pratique de 1mEq de potassium pour 1 gramme de résine.
Chez les nouveau-nés, Kionex ne doit pas être administré par voie orale. Chez les enfants comme chez les nouveau-nés, un dosage excessif ou une dilution inadéquate pourrait entraîner une impaction de la résine. Les prématurés ou les nourrissons de faible poids de naissance peuvent présenter un risque accru d’effets indésirables gastro-intestinaux avec Kionex. utilisation .
Surdosage
Un surdosage peut entraîner des perturbations électrolytiques, notamment une hypokaliémie, une hypocalcémie et une hypomagnésémie. Des mesures appropriées doivent être prises pour corriger les électrolytes sériques (potassium, calcium, magnésium), et la résine doit être éliminée du tube digestif par une utilisation appropriée de laxatifs ou de lavements.
Kionex Description
Kionex est un benzène, diéthényl-polymère, avec éthénylbenzène, sulfoné, sel de sodium et a la formule structurelle suivante:
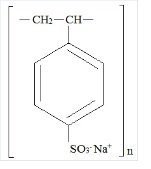
Le médicament est une crème à brun clair finement broyé, forme en poudre de polystyrène sulfonate de sodium, une résine échangeuse de cations préparée dans la phase sodique avec une capacité d’échange in vitro d’environ 3.1 mEq (in vivo environ 1 mEq) de potassium par gramme. La teneur en sodium est d’environ 100 mg (4,1 mEq) par gramme de médicament. Il peut être administré par voie orale ou rectale sous forme de lavement.
Un gramme de Kionex contient 4,1 mEq de sodium.
Kionex – Pharmacologie clinique
Mécanisme d’action
Kionex est un polymère échangeur de cations non absorbé qui contient un contre-ion sodium.
Kionex augmente l’excrétion fécale de potassium par la liaison du potassium dans la lumière du tractus gastro-intestinal. La liaison du potassium réduit la concentration de potassium libre dans la lumière gastro-intestinale, ce qui entraîne une réduction des taux de potassium sérique. Le rapport d’échange pratique est de 1 mEq K pour 1 gramme de résine.
Lorsque la résine passe le long de l’intestin ou est retenue dans le côlon après administration par lavement, les ions sodium sont partiellement libérés et sont remplacés par des ions potassium. Cette action se produit principalement dans le gros intestin, qui excrète les ions potassium dans une plus grande mesure que l’intestin grêle. L’efficacité de ce processus est limitée et variable de manière imprévisible.
Pharmacodynamique
L’abaissement efficace du potassium sérique avec Kionex peut prendre des heures à des jours.
Pharmacocinétique
L’efficacité in vivo des résines d’échange sodium-potassium est d’environ 33 % ; par conséquent, environ un tiers du contenu réel en sodium de la résine est délivré à l’organisme.
Kionex n’est pas absorbé par voie systémique.
Interactions médicamenteuses
Les études de liaison in vitro ont montré que Kionex se liait de manière significative aux médicaments testés suivants – warfarine, métoprolol, phénytoïne, furosémide, amlodipine et amoxicilline.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Des études n’ont pas été réalisées.
Mode de fourniture/stockage et manipulation
Kionex est disponible sous forme de poudre crème à brun clair, finement moulue, en pots de 1 livre (454 g), NDC 0574-2004-16.
Stocker entre 20° et 25°C (68° et 77°F) .
Informations destinées aux patients
Interactions médicamenteuses
Conseiller aux patients qui prennent d’autres médicaments par voie orale de séparer la prise de Kionex d’au moins 3 heures (avant ou après)
Rx Only
Packaged by
Perrigo
Minneapolis, MN 55427
Révisé 08/2017
Emballage/Enveloppe principale
Rx Only
NDC 0574-2004-16
Kionex®
Sulfonate de polystyrène sodique pour suspension
DOSE MAXIMALE POUR ADULTE : 15 g (environ 4 cuillères à café rases) une à quatre fois par jour dans de l’eau. Voir les renseignements thérapeutiques complets.
L’effet doit être soigneusement contrôlé par des déterminations fréquentes du potassium sérique dans chaque période de 24 heures. La teneur en sodium est d’environ 60 mEq par 15 g.
La suspension doit être fraîchement préparée et ne doit pas être conservée au-delà de 24 heures. Distribuer dans des récipients étanches et résistants à la lumière tels que définis dans l’USP.
Conservation : Conserver entre 20° et 25°C (68° et 77°F) .
Lire la notice d’emballage.
454 grammes (1 LB)
| Kionex poudre de polystyrène sulfonate de sodium, pour suspension |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Étiqueteur – Paddock Laboratories, LLC (967694121)
Plus d’informations sur Kionex (polystyrène sulfonate de sodium)
- Effets secondaires
- Grossesse ou allaitement
- Informations sur la posologie
- Interactions médicamenteuses
- En Español
- 4 revues
- Classe de médicaments : Résines échangeuses de cations
- Alertes de la FDA (2)
Ressources pour les consommateurs
- Information pour les patients
- Kionex (Lecture avancée)
.
Ressources professionnelles
- Informations sur la prescription
- Poudre orale de polystyrène sulfonate de sodium (FDA)
Autres marques Kayexalate, Kalexate
Guides de traitement associés
- Hyperkaliémie
Avis médical
.