Les termes ; luminescence, photoluminescence, fluorescence et phosphorescence sont couramment utilisés dans les documents de recherche pour décrire l’émission de lumière à partir d’un échantillon. Cette dénomination multiple peut prêter à confusion, plusieurs de ces termes étant utilisés de manière interchangeable et des chercheurs de différents horizons scientifiques préférant utiliser un nom plutôt qu’un autre. Dans cet article, nous répondons à la question « Quelle est la différence entre la luminescence, la photoluminescence, la fluorescence et la phosphorescence ».
Qu’est-ce que la luminescence ?
La luminescence est toute émission de lumière (ondes électromagnétiques) d’une substance qui ne provient pas d’un chauffage. Cette définition distingue la luminescence de l’incandescence qui est une émission de lumière due à la température élevée d’une substance, comme une braise incandescente. Le mot luminescence est dérivé du mot latin pour lumière, lumen, et du latin, escentia, qui signifie » le processus de » et donc est le processus d’émission de lumière.

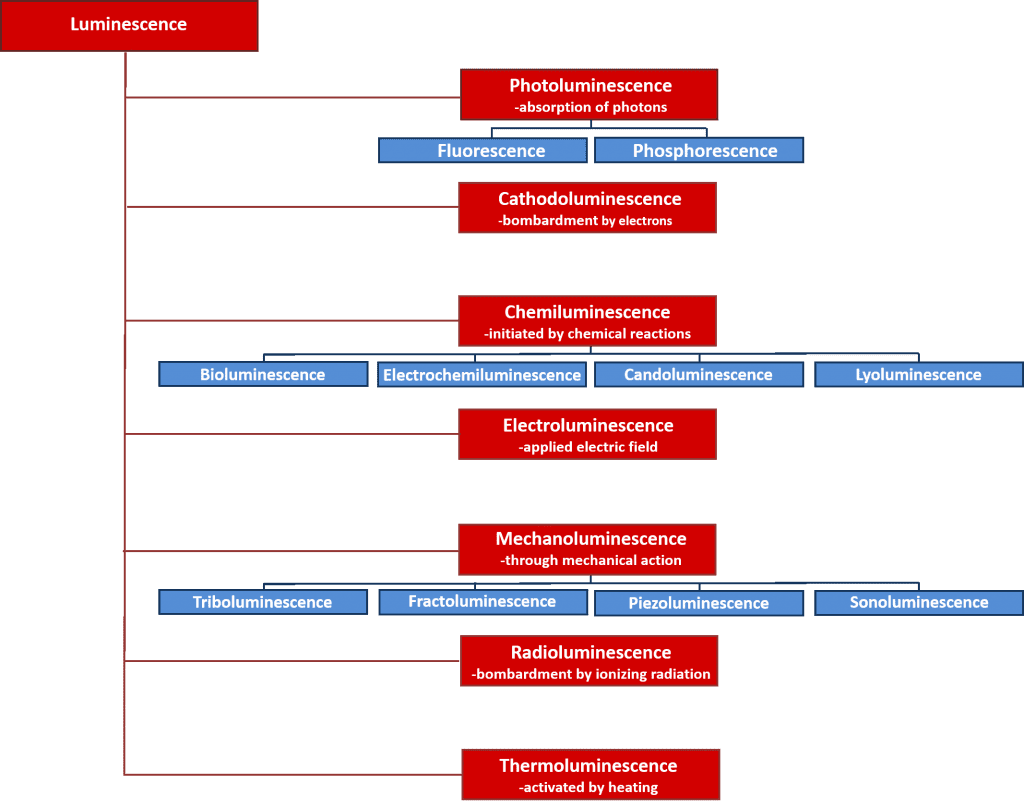
Il existe de nombreux types de luminescence qui peuvent être classés selon la source d’énergie qui initie le processus de luminescence. La figure 2 donne un aperçu des différents types de luminescence et de leurs sources d’énergie. Nombre de ces processus de luminescence ont d’importantes applications scientifiques et industrielles, comme l’électroluminescence, où la lumière est émise lors de la recombinaison des électrons et des trous après l’application d’un champ électrique à travers un matériau, et qui est le principe de fonctionnement des diodes électroluminescentes ; et la chimiluminescence, où l’émission de lumière est initiée par une réaction chimique et utilisée dans des tests biologiques, et qui est responsable de la lueur des bâtons lumineux. Cependant, cet article se concentre sur la photoluminescence qui constitue la base de la puissante technique spectroscopique non destructive, la spectroscopie de photoluminescence, qui est largement utilisée dans les milieux universitaires et industriels.
Qu’est-ce que la photoluminescence ?
La photoluminescence est l’émission de lumière par un matériau suite à l’absorption de la lumière. Le mot en lui-même est intéressant car il est la combinaison du mot dérivé latin luminescence et du préfixe grec, photo-, pour lumière. Toute luminescence induite par l’absorption de photons est appelée photoluminescence. Il peut tout aussi bien s’agir de l’émission de lumière par une molécule de colorant organique en solution (figure 3a), ou de la recombinaison bande à bande des électrons et des trous suite à la photoexcitation d’un semi-conducteur (figure 3b).

Décrire toute émission de lumière induite par l’absorption de photons comme de la photoluminescence est exact ; cependant, il est courant, notamment par les chimistes, de subdiviser davantage la photoluminescence en fluorescence et phosphorescence.
Quelle est la différence entre fluorescence et phosphorescence ?
Il existe diverses définitions de la fluorescence et de la phosphorescence, la plus simple étant que la fluorescence est une photoluminescence rapide qui se produit très peu de temps après la photoexcitation d’une substance, tandis que la phosphorescence est une photoluminescence à longue durée de vie qui se poursuit longtemps après que la photoexcitation a cessé. Bien qu’il s’agisse d’une définition simple, elle n’explique pas pourquoi une telle différence dans les échelles de temps de la photoluminescence se produit et certains matériaux peuvent se trouver dans une zone grise entre les échelles de temps classiques de la fluorescence et de la phosphorescence. Une définition plus approfondie doit être basée sur la mécanique quantique des états excités et fondamentaux impliqués dans le processus d’émission. En utilisant cette approche, la fluorescence et la phosphorescence peuvent être définies comme la photoluminescence où la transition radiative ne nécessite pas un changement de multiplicité de spin et la photoluminescence où la transition radiative implique un changement de multiplicité de spin respectivement.
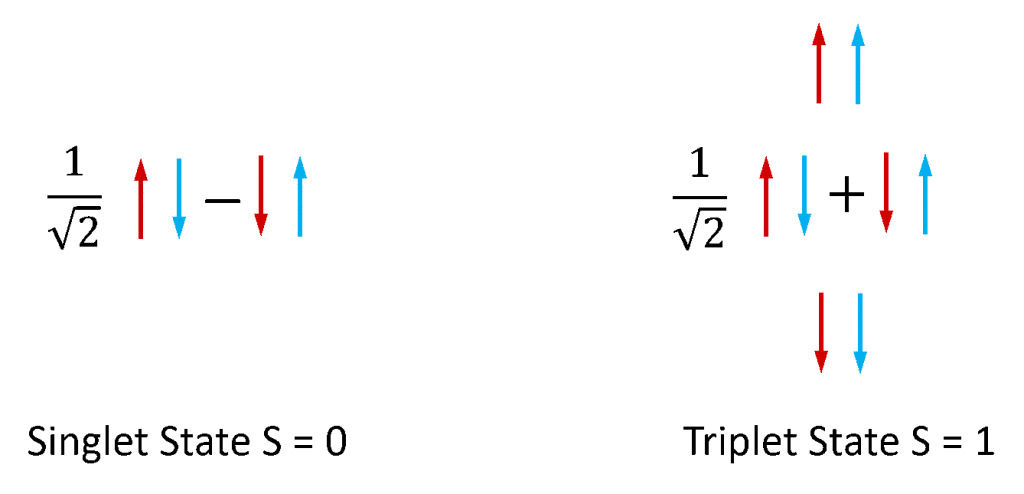
La fluorescence et la phosphorescence sont le plus souvent utilisées pour faire référence à la photoluminescence des systèmes moléculaires. Les électrons dans les molécules stables existent toujours par paires, car les molécules avec des électrons non appariés sont extrêmement réactives et instables. Les électrons possèdent un moment angulaire intrinsèque appelé « spin » et une paire d’électrons peut exister dans l’un des deux états de spin total en fonction de la symétrie relative des spins des deux électrons. Si les deux spins sont dans une configuration antisymétrique, la paire d’électrons a un spin total de zéro (S = 0), tandis que s’ils sont dans une configuration symétrique, la paire a un spin total de un (S = 1). Comme l’illustre la figure 4, il existe une combinaison d’états de paires d’électrons de spin qui est antisymétrique et trois combinaisons d’états de paires de spin qui sont symétriques et les états S = 0 et S = 1 sont donc appelés respectivement singlet et triplet.
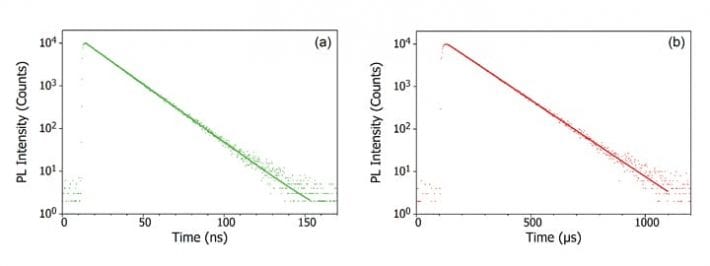
Lorsqu’un photon est absorbé par la molécule, l’un des électrons est promu à un niveau d’énergie plus élevé et la molécule est maintenant dans un état excité. L’état fondamental d’une molécule est (presque) toujours un état singulet (S0) et, en raison de la conservation du moment angulaire, l’état photoexcité doit également être un singulet (S1), comme le montre le diagramme de Jablonski ci-dessous. La désintégration de l’état S1 en retour à l’état S0 est une transition autorisée (puisque les deux états ont la même multiplicité de spin) résultant en une photoluminescence prompte qui se produit à l’échelle de temps de picosecondes à nanosecondes et est appelée fluorescence.
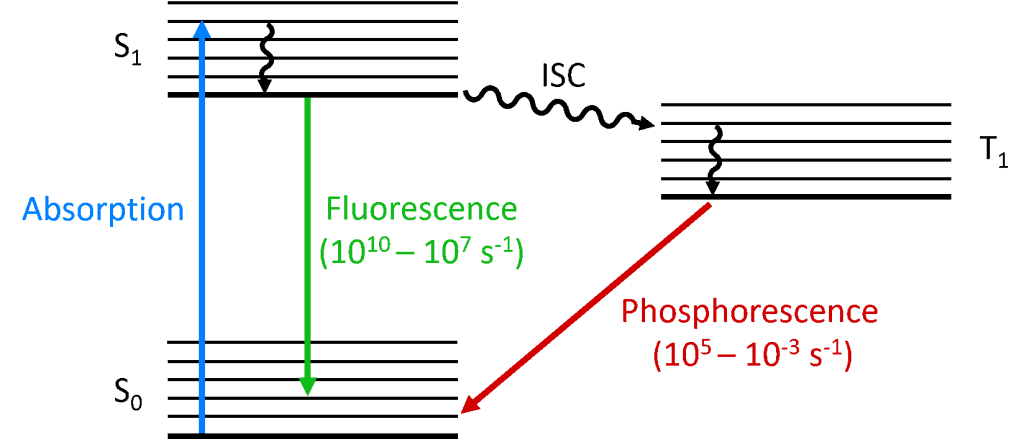
Alternativement, la molécule peut subir un croisement intersystème (ISC) vers l’état triplet excité (T1). L’ISC se produit généralement dans les molécules présentant un degré élevé de couplage spin-orbite, le couplage du moment angulaire orbital et du moment angulaire de spin de l’électron, qui permet la conversion entre les états singlet et triplet. La force du couplage spin-orbite augmente avec la masse de l’atome, et les molécules phosphorescentes doivent donc contenir des métaux lourds tels que l’europium et l’iridium. La désintégration de l’état T1 en S0 est une transition interdite puisque les états ont une multiplicité de spin différente, en raison de la conservation du moment angulaire. Cependant, le couplage spin-orbite relâche cette restriction et une transition radiative de l’état T1 vers l’état S1 devient possible. Comme elle est » interdite « , la photoluminescence qui résulte de la transition T1 vers S0 se produit sur une échelle de temps beaucoup plus lente, de quelques microsecondes à des milliers de secondes, et est appelée phosphorescence.
Il convient également de noter que l’émission de certains matériaux ne tombe pas toujours proprement dans une catégorie ou l’autre. Un exemple de ceci est la fluorescence retardée activée thermiquement (TADF). Dans le cas de la TADF, les niveaux S1 et T1 sont proches en énergie et fortement couplés, et une ISC inverse du T1 au S1 est donc possible. Cela donne lieu à une transition retardée de S1 à S0 qui entraîne une photoluminescence à une échelle de temps comprise entre la fluorescence et la phosphorescence, appelée fluorescence retardée. Pour plus d’informations sur le TADF et son utilisation dans les OLED à haut rendement, lisez le post sur ‘Qu’est-ce que le TADF ?’.
Quand décrire l’émission en tant que photoluminescence par rapport à la fluorescence/phosphorescence est finalement une question de préférence personnelle. Les chimistes et les biologistes, qui étudient principalement les systèmes moléculaires, favorisent l’utilisation de la fluorescence et de la phosphorescence puisque dans ces systèmes moléculaires hautement localisés, il existe des états singlet et triplet distincts. En revanche, les physiciens étudient principalement des matériaux semi-conducteurs où les électrons sont fortement délocalisés et où le concept de singulet et de triplet n’est souvent plus pertinent. C’est l’une des raisons pour lesquelles les physiciens ont tendance à utiliser le terme plus large de photoluminescence pour décrire l’émission de lumière.
Quoi que vous décidiez de l’appeler ; la photoluminescence, la fluorescence et la phosphorescence peuvent fournir une foule d’informations sur les propriétés des molécules et des matériaux ; allant de la détermination de la durée de vie des porteurs de charge dans les cellules solaires à la mesure de la dynamique de solvatation autour des micelles dans les cellules vivantes.
Produits pour la luminescence, la photoluminescence, la fluorescence et la phosphorescence
Pour mesurer la photoluminescence, un spectromètre de photoluminescence est nécessaire et Edinburgh Instruments propose une gamme de spectromètres de photoluminescence à comptage de photons uniques pour mesurer les spectres de photoluminescence, les durées de vie, l’anisotropie et les rendements quantiques de vos échantillons.
Rester en contact
Si vous avez apprécié la lecture de cet article, et que vous souhaitez être le premier à voir toutes les dernières nouvelles, applications et informations sur les produits d’Edinburgh Instruments, alors inscrivez-vous à notre bulletin d’information peu fréquent via le bouton d’inscription rouge ci-dessous, et suivez-nous sur les médias sociaux.