Certains atomes sont plus polaires que d’autres du fait qu’ils sont plus « gourmands » en électrons.
Regardez votre tableau périodique, plus vous allez vers la droite et vers le haut, plus les atomes deviennent électronégatifs (n’incluant pas les gaz nobles car ils ont des coquilles pleines et sont « heureux » et n’ont pas besoin d’électrons de valence).
Je pense que tout le monde a entendu dire que le Farine (F), par exemple, est l’un des éléments les plus électronégatifs, il va littéralement arracher les électrons des atomes d’Hydrogène ou des atomes de carbone. Tout comme le Chlore (Cl)
Check out this image:
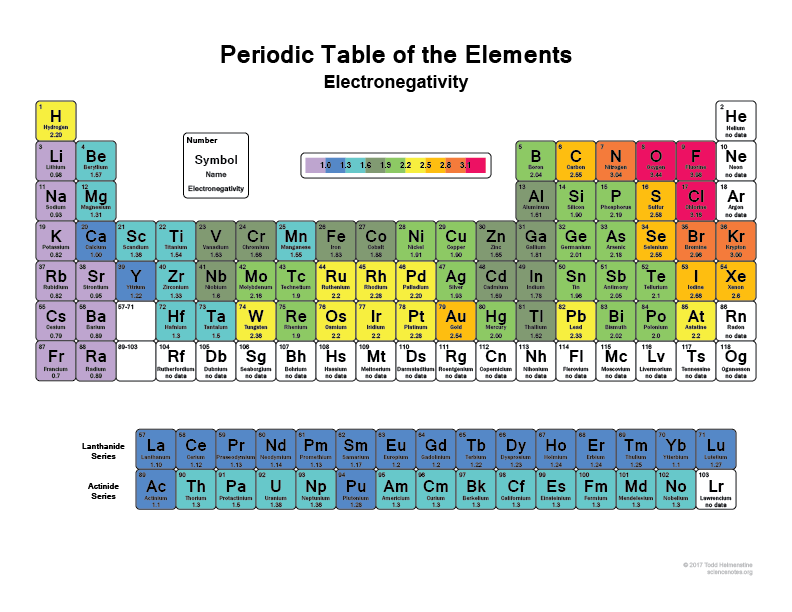
C’est pourquoi lorsqu’une liaison certaines molécules ont des régions super polaires parce qu’elles ont quelque chose comme l’Hydrogène qui se lie avec quelque chose comme le Farine qui a juste fondamentalement les électrons avec lui la plupart du temps.
Cette question peut également être expliquée par l’idée de nuages d’électrons et le fait que les atomes plus électronégatifs auront généralement plus d’électrons restant avec lui la plupart du temps par rapport aux atomes moins électronégatifs.

C’est ce qu’on appelle le moment dipolaire et sans trop entrer dans les détails, vous voyez comment la plupart des électrons sont plus proches de l’oxygène que de l’hydrogène (parce que l’oxygène est plus électronégatif que l’hydrogène)
A propos, le mot électronégatif semble parfois contre-intuitif mais c’est électro-négatif au lieu de positif parce qu’en chimie les atomes qui gagnent des électrons ont un signe négatif (Ex : #Cl^-# est un chlore qui a gagné un électron).