Introduction
La rosacée papulopustuleuse (PPR) est une maladie inflammatoire chronique caractérisée par un érythème facial avec des papules et/ou des pustules localisées préférentiellement sur le visage.
Traditionnellement, elle a été traitée par des tétracyclines orales (principalement la doxycycline) et des antibiotiques topiques, comme le métronidazole1. Un nombre croissant de traitements sont devenus disponibles ces dernières années, notamment l’isotrétinoïne orale2 et les médicaments antiparasitaires tels que l’ivermectine, qui peuvent être administrés par voie topique3 ou orale.4 Dans la pratique clinique, cependant, il existe un nombre appréciable de cas difficiles qui ne répondent pas à ces traitements conventionnels. L’azithromycine, un antibiotique macrolide, s’est avérée être un traitement sûr et efficace de la PPR.5 Nous avons conçu une étude pour évaluer l’utilisation de l’azithromycine pour traiter la PPR qui n’a pas répondu au traitement conventionnel dans notre hôpital6.
Matériel et méthodesConception
Nous avons mené une étude pilote prospective sur 16 patients atteints de PPR entre mars 2016 et septembre 2017.
Critères d’inclusion et d’exclusion
Nous avons inclus les patients atteints de PPR qui avaient reçu un traitement conventionnel à base de doxycycline 100 mg en comprimés toutes les 24h et de métronidazole 0.75% gel topique toutes les 24h pendant 84 jours et qui avaient 1) connu une détérioration clinique (une augmentation du nombre de lésions inflammatoires) suite à ce traitement ou 2) connu une récidive précoce (retour des lésions dans les 8 semaines suivant la fin du traitement) malgré une réduction du nombre de lésions pendant le traitement.
Les patients ayant des antécédents connus de maladie cardiaque ont été exclus.
Tous les patients ont été informés en détail sur l’azithromycine orale et les traitements alternatifs ainsi que sur les conditions de l’étude. Un consentement écrit a été obtenu dans tous les cas. La PPR a été classée selon 4 niveaux de gravité clinique progressive7 (tableau 1).
Stades cliniques de la rosacée papulopustuleuseaa
| Stade clinique | Signes cliniques |
|---|---|
| I | Erythème facial avec absence de papules et pustules |
| II | Erythème facial avec 1-12 papules et/ou pustules |
| III | Erythème facial avec > 20 papules et/ou pustules |
| IV | Erythème facial avec papules et/ou pustules |
| V érythème facial avec papules et/ou pustules et œdème solide persistant (maladie du Morbihan) |
Adapté de Fernandez-.Obregon.7
Les patients ont reçu des comprimés d’azithromycine 500mg pendant 12 semaines en suivant le schéma thérapeutique proposé par Bakar et al.8: 500mg/j pendant 3 jours consécutifs par semaine pendant un mois, suivi de 250mg/j (la moitié d’un comprimé de 500 mg) pendant 3 jours consécutifs par semaine pendant un autre mois, suivi de 500mg une fois par semaine pendant un autre mois (durée totale du traitement : 12 semaines).
Suivi
Les patients ont été programmés pour 2 visites principales pour vérifier l’efficacité à court terme de l’azithromycine orale et une série de visites ultérieures pour vérifier l’efficacité à long terme. Lors de la visite de référence (visite 1), une fois que les patients ont donné leur consentement éclairé pour participer à l’étude, la sévérité de leur PPR a été évaluée et ils ont commencé le traitement établi de 12 semaines d’azithromycine orale. La deuxième visite a eu lieu 8 semaines après la fin du traitement. Lors de cette visite, la réponse clinique a été évaluée sur une échelle à 3 points7 en fonction de l’amélioration par rapport à la situation de départ (tableau 2). Les effets indésirables ont également été consignés, ainsi que la manière dont les patients ont évalué leur amélioration (légère, modérée ou marquée). Le tableau 3 résume les données démographiques des patients et leur réponse au traitement conventionnel et à l’azithromycine orale. Les visites ultérieures visant à évaluer l’efficacité à long terme de l’azithromycine ont eu lieu toutes les 12 semaines. Les résultats de l’évaluation (récurrence des lésions inflammatoires, nombre de semaines sans lésions inflammatoires et réponse à la réintroduction avec l’azithromycine orale chez les patients ayant connu une récurrence) sont résumés dans le tableau 4.
Niveaux de réponse clinique au traitement par azithromycine orale chez les patients atteints de rosacée papulopustuleuseaa
| Niveau de réponse clinique | Signes cliniques |
|---|---|
| + | Réduction de l’érythème facial sans changement du nombre de papules et/ou de pustules |
| ++ | Réduction marquée de l’érythème facial et réduction significative du nombre de papules et/ou de pustules |
| +++ | Peu ou pas d’érythème facial résiduel avec disparition complète des papules et pustules |
Adapté de Fernandez-.Obregon.7
Caractéristiques démographiques, réponse au traitement conventionnel et évolution du stade clinique chez les patients atteints de rosacée papulopustuleuse traités par l’azithromycine orale.
| Patient | Sexe | Age, y | Réponse au traitement conventionnel | Stade clinique à la semaine 0 | Réponse clinique 8 semaines après la fin du traitement par azithromycine orale | Effets indésirables. Effets de l’azithromycine | Amélioration globale selon le patient | |
|---|---|---|---|---|---|---|---|---|
| 1 | Femme | 47 | Récurrence précoce. | II | +++ | Non | Marqué | |
| 2 | Femme | 54 | Détérioration clinique | III | +++ | Non | Marqué | |
| 3 | Femme | 50 | Détérioration clinique | III | +++ | Epigastralgie | Marqué | |
| 4 | Femme | 45 | Détérioration clinique | II | +++ | Non | Marqué | |
| 5 | Homme | 47 | Récidive précoce | III | +++ | Non | Marqué | |
| 6 | Femme | 43 | Récidive précoce | II | +++ | Non | Marqué | |
| 7 | Homme | 37 | Récidive précoce | II | +++ | Non | Marqué | |
| 8 | Homme | 52 | Récurrence précoce | II | +++ | Non | Marqué | |
| 9 | Femme | 25 | Récurrence précoce | II | ++ | Diarrhée | Modérée | |
| 10 | Homme | 82 | Récidive précoce | III | ++ | Non | Modéré | |
| 11 | Homme | 43 | Récurrence précoce | II | +++ | Non | Marqué | |
| 12 | Femme | 66 | Détérioration clinique | III | +++ | Non | Marqué | |
| 13 | Femme | 37 | Détérioration clinique | III | +++ | Non | Marqué | |
| 14 | Homme | 39 | Récidive précoce | II | +++ | Non | Marqué | |
| 15 | Femme | 44 | Récidive précoce | II | +++ | Non | Marqué | |
| 16 | Homme | 44 | Détérioration clinique | . détérioration | IV | +++ | Non | Marqué |
Résultats cliniques à long terme chez les patients atteints de rosacée papulopustuleuse après traitement par l’azithromycine orale.
| Patient | Réapparition des lésions inflammatoires | No. de semaines sans lésions inflammatoires | Réponse à la réintroduction de l’azithromycine orale |
|---|---|---|---|
| 1 | Non | 95 | -. |
| 2 | Non | 68 | – |
| 3 | Non | 40 | – |
| 4 | Oui | 32 | Oui |
| 5 | Oui | 27 | Oui |
| 6 | Non | 28 | – |
| 7 | Non | 36 | – |
| 8 | Non | 20 | – |
| 9 | Non | 20 | – |
| 10 | Non | 32 | – |
| 11 | Non | 30 | – |
| 12 | Non | 17 | – |
| 13 | Non | 16 | – |
| 14 | Non | 28 | – |
| 15 | Non | 24 | – |
| 16 | Non | 16 | – |
Résultats
Sixteize patients (9 femmes et 7 hommes) d’un âge moyen de 47 ans (intervalle, 25-82 ans) ont été inclus. Le traitement PPR conventionnel avait entraîné une détérioration clinique dans 6 cas (Fig. 1A et Fig. 2A). Les 10 autres patients avaient présenté une amélioration initiale mais les lésions étaient revenues dans les 8 semaines suivant l’arrêt du traitement.

A, Augmentation du nombre de papules et de pustules pendant le traitement conventionnel. B, Apparition 8 semaines après la fin du traitement par azithromycine orale.
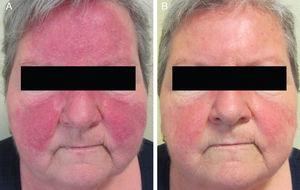
A, détérioration clinique après traitement par doxycycline orale. B, Résolution complète des lésions inflammatoires, avec juste un érythème résiduel, après un traitement par azithromycine orale.
Les niveaux individuels de réponse clinique à 8 semaines sont indiqués dans le tableau 3. L’état des 16 patients s’est amélioré après le traitement par l’azithromycine orale. Lors de la première visite, 9 patients avaient une maladie de stade II, 6 patients avaient une maladie de stade III (Fig. 1A et 2A), et 1 patient avait une maladie de stade IV. Lors de la deuxième visite, 8 semaines après la fin du traitement, 14 patients (87,5 %) présentaient un érythème résiduel faible ou nul et une disparition complète des papules et/ou pustules (+++) (Fig. 1B et 2B). Les 2 autres patients ont présenté une réduction marquée de l’érythème facial et une réduction significative du nombre de papules et/ou de pustules (++).
Aucun des patients n’a décrit son amélioration comme étant légère. Quatorze patients (87,5%) ont considéré qu’ils avaient subi une amélioration marquée, tandis que 2 (12,5%) ont considéré qu’ils avaient subi une amélioration modérée.
Aucune nouvelle lésion inflammatoire (papules ou pustules) n’a été observée lors de la visite de suivi 8 semaines après la fin du traitement chez 14 patients (87,5%). La réintroduction de l’azithromycine par voie orale chez les 2 patients ayant présenté une récidive a permis de résoudre les lésions dans les deux cas (tableau 4).
Deux patients (12,5 %) ont signalé des effets gastro-intestinaux indésirables, mais ceux-ci n’ont pas conduit à l’arrêt du traitement.
Discussion
L’azithromycine est un antibiotique macrolide utilisé depuis les années 1980. C’est un antibiotique largement utilisé pour traiter une série d’infections, notamment la bronchite, la pneumonie, l’otite et les infections sexuellement transmissibles.
Demodex folliculorum,9Chlamydia pneumoniae,10Helicobacter pylori,11 et la prolifération de bactéries intestinales ont tous été impliqués dans l’étiologie et la pathogenèse de la rosacée.12 Le stress environnemental peut également donner lieu à une surproduction d’espèces réactives de l’oxygène, activant la cascade inflammatoire.13,14 L’azithromycine semble avoir des propriétés anti-inflammatoires en plus de ses propriétés antibiotiques,15 car elle bloque la formation d’espèces réactives de l’oxygène, ce qui explique son utilité dans le traitement de la PPR.16,17
Bien que la recommandation d’utiliser l’azithromycine dans le traitement de la PPR soit basée sur des preuves de niveau B, par rapport au niveau A pour la doxycycline,1,18 l’azithromycine s’est avérée aussi efficace que la doxycycline dans ce contexte,5 et, à ce titre, elle peut être une option utile pour les patients qui présentent des effets indésirables ou qui ne répondent pas au traitement conventionnel.19 Tous les patients de notre étude avaient reçu un traitement conventionnel avant d’être traités à l’azithromycine ; 37,5 % avaient connu une aggravation de leur PPR pendant le traitement, tandis que les 62,5 % restants avaient connu une récidive précoce (apparition de nouvelles lésions inflammatoires dans les 8 semaines suivant l’arrêt du traitement). L’azithromycine s’est avérée être un traitement très efficace de la PPR dans des études de cas isolés6,21,22 et des séries.7,8,23,24 Dans notre série, 8 semaines après la fin du traitement à l’azithromycine, 87,5 % des patients n’avaient qu’un érythème facial faible ou nul et leurs papules et pustules avaient complètement disparu. Les 12,5 % restants ont connu une réduction marquée de la rougeur du visage et une réduction significative du nombre de papules et/ou de pustules. Notre série comprenait un homme de 44 ans qui présentait un œdème facial solide persistant (maladie du Morbihan) depuis 10 ans et qui avait été traité par doxycycline orale25, isotrétinoïne orale26 et ivermectine orale4. Ses manifestations s’étaient aggravées avec les 3 traitements, mais l’utilisation de l’azithromycine orale a conduit à la disparition complète du gonflement des sourcils et des lésions inflammatoires. Seuls 2 patients (12,5%) ont connu une récidive des lésions inflammatoires (papules et/ou pustules) dans le suivi à long terme et ils ont tous deux répondu à la réintroduction de l’azithromycine orale.
Il est important de rappeler que les tétracyclines sont contre-indiquées chez les femmes enceintes. L’azithromycine est un médicament de catégorie B pour la grossesse selon la Food and Drug Administration américaine et elle a obtenu des résultats cliniques satisfaisants, sans effets indésirables, chez les femmes enceintes atteintes de PPR.27
L’azithromycine offre des avantages pharmacocinétiques par rapport aux traitements conventionnels pour le traitement de la rosacée, notamment une absorption rapide par les cellules et des concentrations tissulaires soutenues28. Ces avantages réduisent la fréquence d’administration et augmentent ainsi les chances d’adhésion au traitement.6 L’azithromycine a également un taux d’effets indésirables plus faible que les tétracyclines,29 bien que la doxycycline à faible dose (40mg/24h) ait une efficacité similaire à la doxycycline à dose standard (100mg/24h), en plus de moins d’effets indésirables.18 Il est important de connaître le potentiel proarythmogène de l’azithromycine, car le médicament a été lié à un allongement de l’intervalle QT. Dans une étude, l’utilisation de l’azithromycine pour traiter des infections autres que la PPR pendant 5 jours consécutifs chez des patients présentant un risque cardiovasculaire de base élevé a été associée à une légère augmentation des décès cardiovasculaires.30 Par rapport à l’amoxicilline, on a estimé que le traitement par l’azithromycine pendant 5 jours était à l’origine de 47 décès cardiovasculaires supplémentaires pour chaque million de traitements ; le chiffre correspondant pour les patients présentant un risque élevé de maladie cardiovasculaire était de 245.30 Une méta-analyse récente d’études d’observation n’a pas trouvé que l’antibiothérapie par l’azithromycine pendant 5 jours était associée à un risque accru de décès dans la population plus jeune (hazard ratio , 0.95 ; IC 95 %, 0,66-1,09), bien qu’une augmentation du risque ait été observée dans la population plus âgée (HR, 1,64 ; IC 95 %, 1,23-2,19).31 Il semblerait donc souhaitable d’utiliser des traitements autres que l’azithromycine chez les patients âgés atteints de PPR ou chez les patients présentant une cardiopathie connue, car ils pourraient être plus sensibles aux effets arythmogènes du médicament. Aucun des patients de notre étude n’avait de maladie cardiaque connue (tableau 3). Deux étaient âgés de plus de 65 ans et aucun d’entre eux n’a développé d’effets cardiovasculaires indésirables. Les seuls effets indésirables signalés dans le groupe étaient des troubles gastro-intestinaux (épigastralgie et diarrhée chez deux patients). Dans les deux cas, les effets étaient légers, se sont résolus spontanément et n’ont pas conduit à l’arrêt du traitement.
Il existe un certain nombre d’études très intéressantes analysant le lien possible entre un traitement macrolide à long terme et la résistance bactérienne dans le domaine de la pneumologie, où l’azithromycine, grâce à ses propriétés anti-inflammatoires, immunomodulatrices et antibactériennes, a été associée à une réduction de la fréquence des exacerbations, à une réduction du volume des expectorations et à une amélioration de la fonction pulmonaire32. Bien que nous ayons utilisé le schéma thérapeutique proposé par Bakar et al.8 (500mg/j 3 jours par semaine pendant un mois, suivi de 250mg/j 3 jours par semaine pendant un mois, et enfin 500mg/j une fois par semaine pendant un mois (total de 3 mois), des schémas plus longs ont été décrits pour l’azithromycine chez les patients atteints de bronchectasie (250 ou 500mg/j 3 ou 7 fois par semaine pendant 6 à 12 mois).32 Les bactéries commensales résistantes aux macrolides qui peuvent être transmises au sein de la communauté (par ex, streptocoques oropharyngés) ont été détectées chez des patients atteints de bronchectasie. On a constaté que les patients traités par l’azithromycine pendant 5 à 12 mois présentaient une proportion plus élevée de Streptococcus pneumoniae résistant aux macrolides, bien qu’il ne semble pas y avoir de risque de transmission au sein de la communauté dans ces cas. Enfin, on a signalé des cas de résistance à l’azithromycine dans des souches isolées de S pneumoniae après 6 mois de traitement. D’autres études sont nécessaires pour comprendre la signification clinique encore peu claire de l’augmentation de la résistance bactérienne lors d’un traitement à long terme à l’azithromycine32.
Notre étude présente certaines limites, notamment le fait que nous n’avons pas calculé à l’avance la taille de l’échantillon, que nous n’avons pas utilisé de groupe comparatif et que nous n’avons pas effectué d’études microbiologiques ou histologiques des lésions inflammatoires.
Conclusions
Bien que d’autres essais contrôlés randomisés soient nécessaires pour comparer l’azithromycine orale et la doxycycline, l’azithromycine s’est avérée être un traitement efficace à court et à long terme de la PPR. En outre, elle présente un bon profil de sécurité et peut donc être considérée comme une alternative pour le traitement de la PPR réfractaire.
Conflits d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.