A hélium kémiai elem a nemesgázok közé és a nemfémek közé tartozik. William Ramsay fedezte fel 1895-ben.

Adatok zónája
| Besorolása: | A hélium nemesgáz és nem fém | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Színe: | színtelen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomsúly: | 4.00260 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| állapot: | gáz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| olvadáspont: | -272,2 oC, 0,95 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Megjegyzés: Normál légköri nyomáson a hélium nem szilárdul meg, ezért nincs olvadáspontja. A fent megadott olvadáspont 25 atmoszféra nyomáson van. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fűtőpont: | -268,9 oC, 4.2 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronok: | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Protonok: | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Neutronok a leggyakoribb izotópban: | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronhéjak: | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguráció: | 1s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sűrűség 20oC-on: | 0. Hő, energiák, oxidáció, reakciók, vegyületek, sugarak, vezetőképességek

Nasa: A Nap kromoszférájában mintegy 60 000 °C-on ionizált héliumatomok bocsátják ki a képen látható ultraibolya fényt. 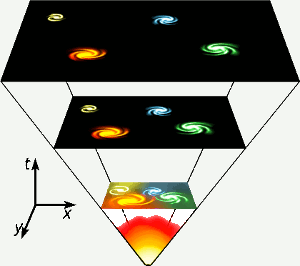
A hélium az univerzum létezésének első három percében keletkezett, amikor a hőmérséklet mindenütt elég magas volt ahhoz, hogy a magfúzió bekövetkezzen. Ezt a rövid, nagy energiájú fázist ábrázolja az ábra legalsó része. A hélium a hidrogén magfúziójával is keletkezik az olyan csillagokban, mint a miénk. Kép: Gnixon 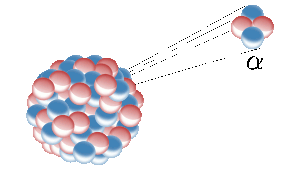
A hélium a Földön radioaktív elemek, például az uránium maghasadásából származik. Itt egy radioaktív atommag héliummagot (más néven alfa-részecskét) bocsát ki. Kép: Inductiveload 
Hélium spektruma kiemelkedő sárga vonallal. Kép: Nasa 
William Ramsay a periódusos rendszer nemes (vagy inert) gázokat tartalmazó utolsó oszlopára mutat. Ramsay 1904-ben kémiai Nobel-díjat kapott az inert gázok felfedezésében végzett munkájáért. Kép: Vanity Fair A hélium felfedezéseDr. Doug Stewart
A hélium felfedezésének története összefonódik a csillagok természetének felfedezésével. Egy időben az emberek azt hitték, hogy soha nem fogjuk megtudni, miből állnak a csillagok. Auguste Comte francia filozófus 1835-ben kijelentette: “soha semmilyen módon nem leszünk képesek tanulmányozni kémiai összetételüket”. (1) Comte úgy gondolta, hogy csak akkor tudhatjuk meg, hogy milyenek a csillagok anyagai, ha be tudjuk juttatni a laboratóriumba. Comte pesszimizmusa ellenére a hélium felfedezésének módszerét és a csillagok összetételét már megtalálták. Joseph Fraunhofer német fizikus 1814-ben átvette Isaac Newton módszerét a napfény prizma segítségével történő felosztására, és döntő előrelépést tett. Fraunhofer sötét vonalakat vett észre a prizma által felhasított napfényből származó szivárvány színeiben; az általa látott vonalak voltak a csillagok spektrumának első megfigyelései. (2), (3) 1859/60-ban Gustav Kirchhoff és Robert Bunsen német tudósok hatalmas előrelépéseket tettek a spektroszkópia tudományában, többek között felfedezték, hogy a Fraunhofer által látott sötét vonalak olyanok, mint egy anyag ujjlenyomata. A terep készen állt arra, hogy Kirchhoff és Bunsen új elemeket fedezzen fel az égő anyagok fényének vizsgálatával. 1860-ban felfedezték a céziumot a kék színképvonalak, 1861-ben pedig a rubídiumot két vörös színképvonal alapján. Majd William Crookes 1861-ben felfedezte a talliumot, miután egy fényes zöld színképvonalat figyelt meg. Kirchhoff és Bunsen a Nap spektrumát vizsgálva arra a következtetésre jutottak, hogy a Nap izzó légkörében vas van jelen. (4) A hélium felfedezéséhez még néhány évre volt szükség. 1868 augusztusában esedékes volt az első teljes napfogyatkozás Kirchhoff és Bunsen munkájának publikálása óta. Pierre Janssen francia csillagász azért várta a napfogyatkozást, hogy spektroszkóp segítségével megfigyelhesse a Nap koronájának protuberanciáit. A napfogyatkozást követő két hétben Janssen kifejlesztett egy módszert a protuberanciák színképének rögzítésére napfogyatkozás nélkül. Ezekben a spektrumokban egy sárga vonalat figyelt meg. (5) A vonal hasonló, de nem azonos helyzetben volt, mint a nátrium spektrumában lévő vonalak. Ezeket a D1 és D2 vonalaknak nevezte el. Norman Lockyer angol tudós tanulmányozta az új sárga vonalat; később D3 vonalnak nevezték el.” A vonalról szóló tanulmányát annak tudatában tette közzé, hogy azt egy új elem okozhatja: “…tehát akkor már tudtuk, hogy nem hidrogénnel van dolgunk; tehát egy olyan elemmel van dolgunk, amelyet nem tudtunk laboratóriumainkban beszerezni, és ezért magamra vállaltam a hélium szó megalkotását, elsősorban laboratóriumi használatra.” (6) A hélium elnevezés a Napot jelentő görög helios szóból származik. Lockyernek és munkatársának, Edward Franklandnek számos más elképzelése volt a sárga vonal lehetséges okairól, ezért nem jelentettek be új elemet. 1871-re más tudósok is tisztában voltak a helyzettel. Lord Kelvin a “Nap körül izzó hidrogén és “hélium” fényének visszaverődéséről” értekezett. A “hélium” használatát egy lábjegyzet követi, hogy megmagyarázza: “Frankland és Lockyer úgy találja, hogy a sárga protuberanciák nagyon határozott fényes vonalat adnak nem messze a D-től, de eddig nem azonosították semmilyen földi lánggal. Úgy tűnik, hogy ez egy új anyagra utal, amelyet ők Héliumnak javasolnak nevezni.” (7) A hélium létezését azonban nem fogadta el mindenki. (5) Minden kétséget eloszlatott, amikor William Ramsay skót kémikus 1895-ben Londonban izolálta a héliumot. Ramsay 1894-ben együtt fedezte fel az argont; az argon volt az első a nemesgázok közül, amelyet felfedeztek. 1895-ben olvasta William Hillebrand tanulmányát, amelyben leírta, hogy az urán ásványhoz, az uranithoz sav hozzáadásakor nem reagáló gáz szabadult fel. Hillebrand úgy vélte, hogy a gáz nitrogén. Ramsay, aki úgy vélte, hogy a gáz argont tartalmazhat, megismételte Hillebrand kísérletét egy másik uránásvány, a cleveit felhasználásával, és összegyűjtötte a gázt. Spektroszkópja nitrogén, argon és egy másik gáz jelenlétét mutatta ki. Ramsay gyanította, hogy ez hélium lehet, mert úgy tűnt, hogy van egy D3 vonal. (8) Mivel tudta, hogy Lockyernek és William Crookesnak jobb spektroszkópja van, mint neki, elküldte nekik a gázból vett mintát. Sajnos a minta nem volt megfelelő, ezért Lockyer szerzett egy uranitmintát, kivonta a gázt, és spektroszkóppal tanulmányozta. Ezt írja: (8) “Egytől egyig az általam 1868-ban a Napban megfigyelt ismeretlen vonalakról kiderült, hogy a gázhoz tartoznak.” A gáz spektruma azonos volt a Nap “héliumával”. Egy új elem nyerte el helyét a periódusos rendszerben. Látogasson el a Chemicool hűvös hélium tényeket tartalmazó oldalára.  A legtöbb ember tudja, hogyan hangzik a hélium belégzése utáni beszéd. Ha nem tudod, hallgasd meg itt. És mi a helyzet a kén-hexafluoriddal?
Az abszolút nulla közelében a hélium szuperfolyóssá válik. Hogyan viselkedik?
Megjelenés és tulajdonságokÁrtalmas hatások: A héliumról nem ismert, hogy mérgező lenne. Jellemzők: A hélium könnyű, szagtalan, színtelen, inert, egyatomos gáz. Képes kétatomos molekulákat képezni, de csak gyengén és az abszolút nulla fokhoz közeli hőmérsékleten. A hélium olvadáspontja az összes elem közül a legalacsonyabb, forráspontja pedig az abszolút nulla fok közelében van. A többi elemtől eltérően a hélium nem szilárdul meg, hanem szokásos nyomáson az abszolút nulla fokig (0 K) folyékony marad. Annak a hangja, aki átmenetileg héliumot lélegzett be, magasan szól. A hélium felhasználásaA hélium legnagyobb felhasználója a mágneses rezonanciás képalkotás (MRI). A héliumot az MRI-szkennerek szupravezető mágneseinek hűtésére használják. A héliumot léggömbök (léghajók) töltésére és folyékony üzemanyaggal működő rakéták nyomás alá helyezésére használják. A hélium és az oxigén keverékét mesterséges “levegőnek” használják búvárok és más, nyomás alatt dolgozó személyek számára. A héliumot a normál levegőben lévő nitrogén helyett használják, mert hosszú merülés után a hélium gyorsabban távozik a szervezetből, mint a nitrogén, ami gyorsabb dekompressziót tesz lehetővé. A héliumot gázpajzsként használják ívhegesztés közelében, megakadályozva például a forró fémhegesztések oxigénnel való reakcióját. A gázt a félvezetőiparban használják a szilícium- és germániumkristályok növesztéséhez szükséges inert atmoszféra biztosítására. Magas hőmérsékletű gázként a titán- és cirkóniumgyártásban, valamint vivőgázként a gázkromatográfiában is használják. Bőség és izotópokBőség Földkéreg: 8 rész/milliárd tömeg, 43 rész/milliárd molban Bőség Naprendszer: 23 % tömeg, 7,4 % molban Költség, tisztán: 5,2 $/100g Költség, ömlesztve: $/100g Forrás: A Földön található hélium szinte teljes mennyisége radioaktív bomlás eredménye. A hélium fő forrásai a texasi, oklahomai és kansasi kutakban található földgázlelőhelyekből származnak. A héliumot a földgáz frakcionált desztillációjával nyerik ki, amely akár 7% héliumot is tartalmazhat. Izotópok: A héliumnak 8 izotópja van, amelyek felezési ideje ismert, tömegszámuk 3-tól 10-ig terjed. A természetben előforduló hélium két stabil izotópjának, a 3He-nek és a 4He-nek a keveréke, amelyek természetes gyakorisága 0,0001%, illetve 99,999%. 
Cite this PageOnline hivatkozáshoz, kérjük, másolja be az alábbiak egyikét: <a href="https://www.chemicool.com/elements/helium.html">Helium</a> vagy <a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a> Az oldal tudományos dokumentumban való idézéséhez, kérjük, használja a következő MLA-konform idézetet: "Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||