I coloranti sono usati in molte industrie – per colorare vestiti, vernici, plastiche, fotografie, stampe e ceramiche. I coloranti sono ora utilizzati anche in nuove applicazioni e sono definiti funzionali (alta tecnologia) in quanto non sono inclusi nel prodotto solo per ragioni estetiche ma per scopi specifici, per esempio in chirurgia.
I coloranti possono essere sia coloranti che pigmenti. I coloranti sono composti organici colorati solubili che vengono solitamente applicati ai tessuti da una soluzione in acqua. Sono progettati per legarsi fortemente alle molecole di polimeri che compongono la fibra tessile.
I pigmenti sono composti insolubili usati nelle vernici, negli inchiostri da stampa, nella ceramica e nella plastica. Vengono applicati utilizzando una dispersione in un mezzo adatto. La maggior parte dei pigmenti usati sono anche composti organici.
- Manipolare il colore e l’applicazione dei coloranti
- La colorazione dei tessuti
- Classificazione dei coloranti
- Classificazione dei coloranti in base alla loro struttura chimica
- (a) Coloranti azoici
- (b) Coloranti antrachinone
- (c) Ftalocianine
- Classificazione dei coloranti secondo i metodi di applicazione
- Coloranti del gruppo 1
- (i) Coloranti acidi
- (ii) Coloranti a complesso metallico
- (iii) Coloranti diretti
- (iv) Coloranti basici
- (v) Coloranti dispersi
- Coloranti del gruppo 2
- i) Coloranti reattivi
- (ii) Coloranti al tino
- (iii) Coloranti a base di zolfo
- Pigmenti
- Tinture e pigmenti funzionali (alta tecnologia)
- (a) Display a cristalli liquidi
- (b) Coloranti laser
- (c) Stampa a getto d’inchiostro
- (d) Terapia fotodinamica
Manipolare il colore e l’applicazione dei coloranti
Questa sezione considera alcuni aspetti della chimica dietro il colore dei coloranti e come il materiale di destinazione, per esempio una fibra, influenza il metodo di tintura e il colorante usato.
Un colorante in soluzione è colorato a causa dell’assorbimento selettivo di certe lunghezze d’onda della luce da specifici legami nella molecola. La luce che viene trasmessa viene vista dall’osservatore e appare colorata perché alcune delle lunghezze d’onda dello spettro visibile vengono a mancare.

Figura 1 La mauveina fu il primo colorante sintetico in assoluto. Fu prodotta accidentalmente da William Perkin nel 1856 che stava cercando di sintetizzare il chinino. Divenne particolarmente popolare quando la regina Vittoria indossò un abito di seta tinto di malva alla Royal Exhibition del 1862 a Londra.
Per gentile concessione della Society of Dyers and Colourists.
L’assorbimento dell’energia della luce visibile da parte del composto promuove gli elettroni nella molecola da uno stato di bassa energia, lo stato fondamentale, a uno stato di energia superiore, lo stato eccitato. Si dice che la molecola ha subito una transizione elettronica durante questo processo di eccitazione. Particolari energie di eccitazione corrispondono a particolari lunghezze d’onda della luce visibile.
È un elettrone n (un elettrone in un doppio o triplo legame) che viene promosso allo stato eccitato. Ancora meno energia è richiesta per questa transizione se nella stessa molecola esistono legami singoli e doppi alternati (cioè doppi legami coniugati). L’eccitazione dell’elettrone è resa ancora più facile dalla presenza di anelli aromatici a causa della maggiore delocalizzazione degli elettroni n.
Alterando la struttura del composto, i chimici del colore possono alterare la lunghezza d’onda della luce visibile assorbita e quindi il colore del composto.
Le molecole della maggior parte dei composti organici colorati contengono due parti:
(i) un singolo anello arilico (aromatico) come il benzene o un anello benzenico con un sostituente. In alternativa ci può essere un sistema di anelli fusi come il naftalene (due anelli fusi insieme) o l’antracene (tre anelli fusi insieme).
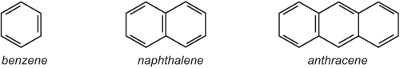
Dove gli anelli si uniscono, condividono due atomi di carbonio e quindi il naftalene con due anelli ha 10 atomi di carbonio, non 12. Allo stesso modo, l’antracene ha 14 atomi di carbonio invece di 18. Poiché la naftalina e l’antracene contengono elettroni delocalizzati su tutti gli anelli, è inappropriato usare il simbolo delocalizzato che si usa per il benzene nelle altre unità, perché ciò indicherebbe due o tre sistemi delocalizzati separati. Così in questa unità si usano strutture Kekule.
(ii) un esteso sistema di doppio legame coniugato contenente gruppi insaturi, noti come cromofori, come:
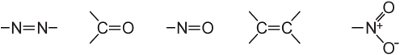
L’intensità del colore può essere aumentata in una molecola colorante mediante l’aggiunta di sostituenti contenenti coppie solitarie di elettroni all’anello arilico come:
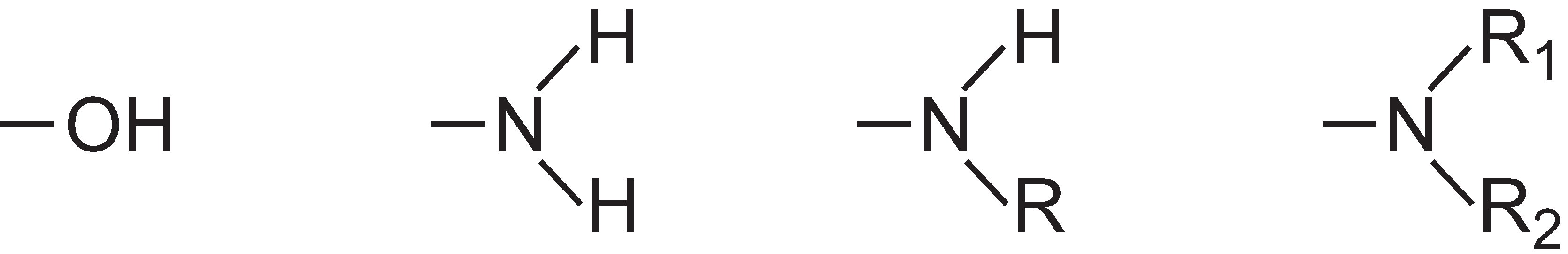
Questi gruppi sono noti come auxocromi.
A volte l’intera struttura del colorante è chiamata cromogeno.
Per rendere il colorante importante a livello industriale, i chimici del colore devono anche essere in grado di alterare la solubilità del composto, e possono essere inclusi gruppi per rendere il colorante solubile in acqua. Gli esempi includono il gruppo acido solfonico, -SO3H, o il gruppo acido carbossilico, -COOH, o più solitamente, il sale di sodio di questi acidi, -SO3-Na+ e -COO-Na+, rispettivamente.
Un’altra preoccupazione chiave dei chimici che sviluppano i coloranti è di migliorare la sua reattività con l’oggetto che vogliono colorare, per esempio le molecole della fibra. Questo è discusso di seguito e gli esempi sono dati in tutta l’unità.
La colorazione dei tessuti
La natura chimica di un colorante è determinata dalle proprietà chimiche e fisiche delle fibre del tessuto da colorare. I quattro tipi principali di fibre (tabella 1) sono proteiche, cellulosiche, rigenerate (a base di cellulosa o derivati) e sintetiche.
| Fibre naturali | Fibre artificiali | ||
|---|---|---|---|
| Proteiche | Cellulosa | Rigenerata | Sintetica |
| Lana | Cotone | Viscosa rayon | Poliammidi |
| Seta | Lino | Celulosa etanoati | Poliesteri |
| Mohair | Ramie | Acrilici | |
| Cashmere | |||
| Il termine rigenerato è usato quando un polimero naturale è stato trattato chimicamente per formare un altro polimero. Per esempio, la cellulosa naturale delle piante, se trattata con anidride etanoica (anidride acetica), produce un polimero, l’etanoato di cellulosa, che è il rayon. |
|||
Tabella 1 Classificazione delle fibre tessili.
Durante il processo di tintura di un tessuto, il colorante si distribuisce tra le due fasi, la fase solida della fibra e la fase acquosa, e alla fine del processo di tintura la soluzione è esaurita e la maggior parte del colorante è associato alla fibra. Una volta che le molecole di colorante penetrano nella fibra, c’è un’interazione immediata tra i due componenti, che impedisce il desorbimento delle molecole di colorante nella soluzione. Il tipo di interazione, fisica o chimica, dipenderà dai gruppi sulle molecole di colorante e nelle catene delle fibre (tabella 2).
| Tipo di legame | Forza relativa approssimativa |
|---|---|
| covalente | 30.0 |
| ionico | 7.0 |
| idrogeno | 3.0 |
| altro intermolecolare | 1.0 |
Tabella 2 Forza relativa approssimativa di legame tra un colorante e un tessuto.

Figura 2 Prima di usare un colorante, bisogna determinarne la solidità alla luce. Questi
rack, situati sulla costa nord-est dell’Australia, sono utilizzati per molte prove di
intemperie, tra cui la solidità del colore. La posizione delle rastrelliere può
essere modificata, ma nella foto, sono ad un angolo di 45° rispetto all’orizzontale.
Per gentile concessione dell’Allunga Exposure Laboratory.
La solidità del colore di un tessuto colorato è definita come la sua resistenza al cambiamento quando è sottoposto ad una particolare serie di condizioni. Il colorante non dovrebbe essere influenzato molto dalla luce del sole (solidità alla luce), dal calore quando il tessuto viene stirato (solidità al calore), dal sudore (solidità al sudore) e dal lavaggio (solidità al lavaggio).
Classificazione dei coloranti
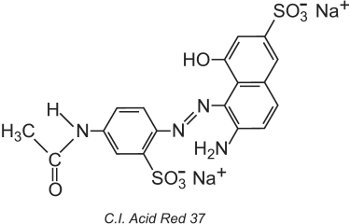
Il Colour Index International, prodotto dalla Society of Dyers and Colourists, a Bradford, è un elenco completo di coloranti e pigmenti commerciali conosciuti e viene aggiornato regolarmente. Ad ogni colorante viene dato un nome e un numero di Colour Index (C.I.). Per esempio:
Tutti i coloranti della lista sono stati classificati in base alla loro struttura chimica e al loro metodo di applicazione.
Classificazione dei coloranti in base alla loro struttura chimica
Il Colour Index assegna i coloranti di struttura nota a una delle 25 classi strutturali secondo il tipo chimico. Tra le più importanti ci sono:
a) coloranti azoici
b) coloranti antrachinonici
c) ftalocianine
(a) Coloranti azoici
I coloranti azoici costituiscono la classe chimica più grande, contenendo almeno il 66% di tutti i coloranti. La caratteristica è la presenza nelle strutture di uno o più gruppi azoici,

insieme a gruppi idrossilici, gruppi amminici e ammine sostituite come auxocromi.
I composti azoici aromatici sono prodotti da ammine aromatiche attraverso il corrispondente sale di diazonio.
Un sale di diazonio si forma quando un’ammina aromatica è trattata con acido nitroso (nitrico(III)). L’acido nitroso si forma in situ aggiungendo acido cloridrico diluito a una soluzione fredda di nitrito di sodio a circa 278 K. Nell’esempio seguente, una soluzione di cloruro di benzenediazonio è stata formata dalla fenilammina (anilina), l’ammina aromatica più semplice:

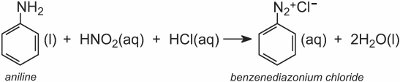
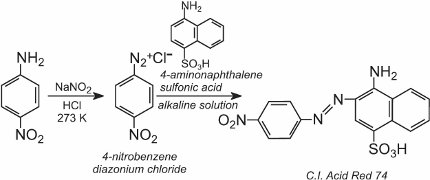
Una soluzione di un altro composto come un’altra ammina aromatica o un fenolo viene poi aggiunta alla soluzione fredda e produce un composto azoico che è colorato. Un esempio è la formazione di un colorante rosso quando una soluzione acquosa di acido 4-amminonaftalensolfonico (acido naftionico) viene aggiunta a una soluzione di cloruro di 4-nitrobenzenediazonio per formare C.I. Rosso acido 74:
L’azobenzene è il cromoforo di questi coloranti azoici,
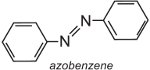
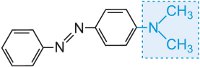
e il colore della molecola può essere modificato e l’intensità del colore aumentato variando gli auxocromi (tabella 3).
| Struttura | Colore osservato |
|---|---|
 |
giallo-verde |
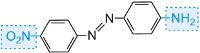 |
giallo |
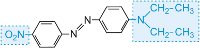 |
rosso |
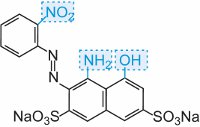 |
blu |
 |
Tabella 3 Le strutture molecolari di alcuni coloranti azoici che mostrano gli auxocromi.
Alcuni coloranti azoici, quelli che contengono un gruppo idrossilato orto (o para) al gruppo azo, per esempio l’Arancio Acido C.I. 7, mostrano il tautomismo, un processo in cui la molecola esiste come due o più strutture diverse in equilibrio. L’atomo di idrogeno sul gruppo idrossile è in grado di migrare verso l’atomo di azoto del gruppo azo e viceversa:
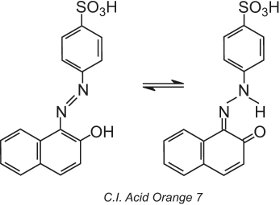
Questo tipo di tautomerismo comporta un equilibrio tra un tautomero idrossiazo e un tautomero chetoidrazonico, anche se il tautomero chetoidrazonico generalmente domina e il colore osservato è di lunghezza d’onda maggiore (uno spostamento batocromico).
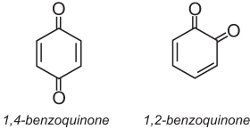
(b) Coloranti antrachinone
I coloranti antrachinone rappresentano circa il 15% dei coloranti e hanno strutture basate su chinoni. Il chinone più semplice è il benzochinone, che ha due isomeri:
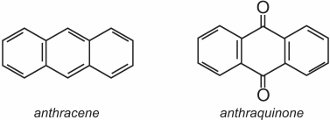
L’antrachinone, il più semplice degli antrachinoni, è basato sull’antracene:
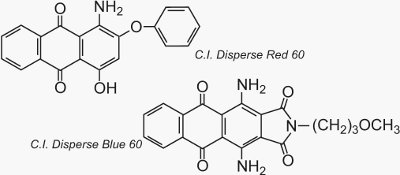
Due esempi ben noti di antrachinoni usati come coloranti sono C.I. Disperse Red 60 e C.I. Disperse Blue 60:
(c) Ftalocianine
Le ftalocianine sono essenzialmente costituite da quattro molecole di isoindolo:
Queste molecole sono collegate tra loro in una ftalocianina da atomi di azoto. La struttura della ftalocianina è:
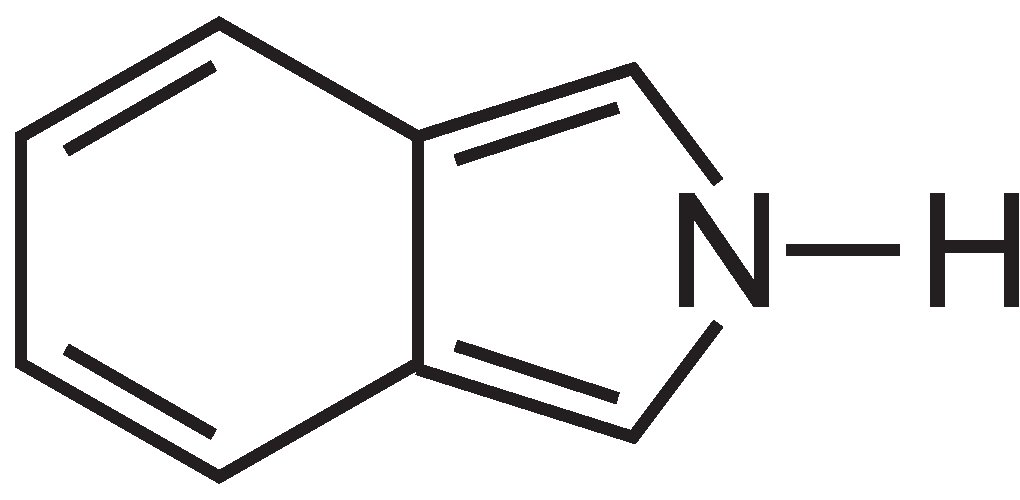
Queste molecole sono collegate tra loro in una ftalocianina da atomi di azoto. La struttura della ftalocianina è:
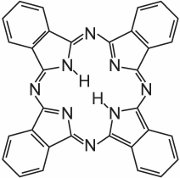
Le ftalocianine si coordinano con gli atomi di metallo. Le più importanti, che contribuiscono a circa il 2% di tutti i coloranti, sono le ftalocianine di rame, utilizzate per i loro brillanti colori blu e verde. Un esempio è il C.I. Direct Blue 86:
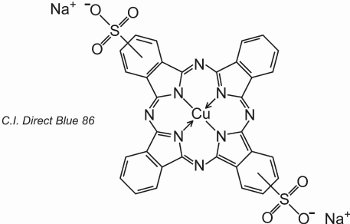
I gruppi di acido solfonico aiutano la solubilità del colorante in acqua.
La formula indica che i gruppi di acido solfonico possono essere in posizioni diverse sugli anelli aromatici.
Classificazione dei coloranti secondo i metodi di applicazione
La classificazione secondo il metodo di applicazione è importante per il tintore tessile che applica il colorante per produrre il colore richiesto. Per ottenere la tonalità desiderata, il tintore di solito deve fare delle miscele di coloranti e deve assicurarsi che queste siano compatibili.
Le caratteristiche di base che controllano il trasferimento del colorante dalla soluzione alla fibra sono:
- il pH della soluzione nel bagno di tintura (per coloranti acidi e basici)
- un elettrolita (una soluzione di solfato di sodio o cloruro)
- la temperatura (nell’intervallo da ambiente a 400 K)
- le sostanze chimiche, noti come agenti disperdenti, che producono una dispersione acquosa stabile di coloranti a bassissima solubilità
La tabella 4 elenca i coloranti con i loro nomi tecnologici che indicano come vengono applicati, insieme alle fibre alle quali vengono applicati.
| Tintura | Fibra |
|---|---|
| Gruppo 1 | |
| Acido | Lana e altre fibre proteiche, poliammidi |
| Complesso metallico | Lana e altre fibre proteiche, poliammidi |
| Dirette | Cotone, lino, viscosa |
| Basico | Acrilico |
| Disperse | Poliesteri, poliammidi, etanoati |
| Gruppo 2 | |
| Reattivo | Cotone, lino, viscosa, lana, seta |
| Vat | Cotone, lino, viscosa |
| Zolfo | Cotone, lino |
Tabella 4 Classificazione tecnologica dei coloranti.
Coloranti del gruppo 1
I coloranti di questo gruppo sono caratterizzati dalla loro solubilità in acqua. Di conseguenza non sono particolarmente veloci al lavaggio. Il metodo di applicazione prevede solo un processo in una sola fase.
(i) Coloranti acidi
I tipi chimici importanti sono l’azo, l’antrachinone e la ftalocianina, che coprono tutto lo spettro visibile e danno quindi una gamma completa di colori. Questi coloranti sono solubili in acqua dando specie anioniche. Di solito vengono applicati a circa 373 K. Mentre la lana e altre fibre proteiche si degradano facilmente al di sopra di questa temperatura, le fibre poliammidiche (per esempio, i nylon) possono essere trattate a 393 K senza che vengano danneggiate (tabella 4).
Il pH scelto per la soluzione nel bagno di tintura dipende dalle proprietà individuali dei coloranti. I valori più bassi si ottengono aggiungendo acido solforico e quelli più alti aggiungendo soluzioni di acido etanoico e solfato di ammonio o etanoato di ammonio. Il solfato di sodio può essere aggiunto per controllare la diffusione degli anioni del colorante nella struttura della fibra.
Per la natura stessa della struttura del colorante, si formeranno legami ionici, legami idrogeno e altre interazioni intermolecolari (Tabella 2) tra il colorante e la fibra, rendendo così i coloranti veloci. Un esempio di un tipico colorante acido è il C.I. Acid Red 73:
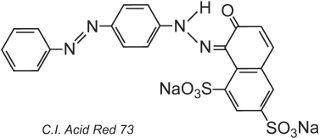
Uno dei gruppi azoici in questo tautomero è presente sotto forma di chetoidrazone.
(ii) Coloranti a complesso metallico
I tipi chimici sono azo e antrachinone che danno una gamma completa di colori. Tuttavia sono più opachi dei coloranti acidi a causa della presenza nella struttura del colorante di un atomo di metallo. I sali di cromo sono spesso usati anche se i sali di cobalto e di nichel sono anche favoriti.
L’atomo di metallo forma un complesso di coordinazione con due molecole di un composto monoazo contenente gruppi idrossilici, carbossilici o amminici nelle posizioni 2,2′ relative al gruppo azo. Questi composti sono chiamati coloranti “complessi metallici 1:2”. Un esempio è il C.I. Acid Violet 78:
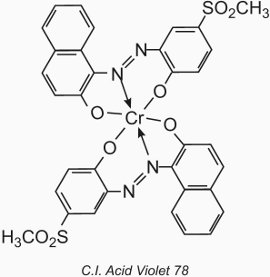
La loro applicazione alla lana è simile a quella dei coloranti acidi, ma il valore del pH è limitato all’intervallo da 4,5 a 6,0 (tabella 4).
(iii) Coloranti diretti
I coloranti diretti sono particolarmente utili per tingere le fibre di cellulosa (Tabelle 1 e 4).
Sono sintetizzati con gruppi di acido solfonico per dare loro solubilità in acqua, dissociandosi per dare cationi di sodio e la specie colorante anionica. Sono anche progettati in modo che siano il più lineare e planare possibile nella struttura. Questo permette al colorante di essere attaccato alle catene cellulosiche della fibra, spesso attraverso un legame intermolecolare (incluso l’idrogeno).
Sono applicati nel bagno di tintura in una soluzione acquosa che contiene cloruro di sodio. Il sale riduce le forze elettriche di repulsione tra la carica negativa sulla superficie della fibra e la specie anionica del colorante.
La maggior parte dei coloranti diretti sono composti azoici, spesso contenenti due o tre gruppi azoici. Gli esempi includono C.I. Direct Orange 25 che ha -OH, -NHCO- e -N=N-gruppi che hanno tutti il potenziale di formare legami idrogeno con i gruppi idrossilici nella cellulosa:
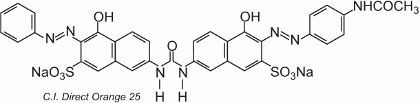
Il colorante mostra tautomeria, poiché ci sono due gruppi idrossilici orto ai gruppi azoici. Uno dei tautomeri in equilibrio con questa forma è
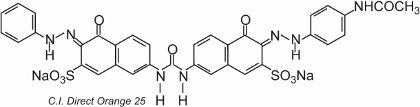
dove ci sono due gruppi chetoidrazonici.
Un altro esempio, C.I. Direct Blue 71, ha tre gruppi azoici, uno dei quali è presente come tautomero chetoidrazonico:
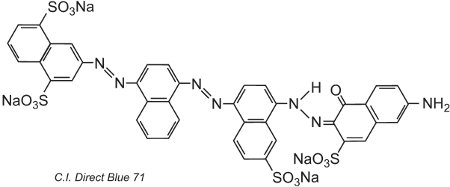
(iv) Coloranti basici
I coloranti basici furono tra i primi coloranti sintetici. Infatti la malva è un colorante basico. Il cromoforo è presente come catione e sono usati oggi nella tintura delle fibre acriliche (di solito un copolimero con propenonitrile (acrilonitrile) e una piccola quantità di un co-monomero che contiene gruppi solfonati, -SO3-, e carbossilati, -CO2-). Si tratta di interazioni ione-ione (tabelle 2 e 4).
Ci sono circa 100 coloranti basici (cationici) i cui colori spaziano tra i rossi, i gialli e i blu, con tonalità forti e brillanti. Alcuni sono basati sui sistemi di cromofori azo e antrachinone. Molti sono anche basati su ioni arilcarbonio. Esempi includono il C.I. Basic Green 4 (conosciuto come Malachite Green) e il C.I. Basic Red 9.
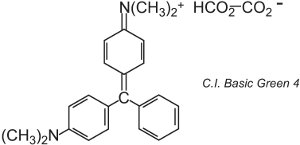 |
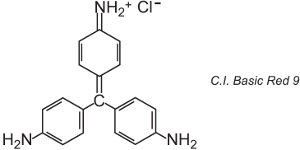 |
Sono entrambi triarilmetani, un gruppo di coloranti che con cambiamenti relativamente piccoli nella struttura produce una gamma di tonalità rosse, verdi e viola.
Altri, noti come coloranti polimetallici (contengono uno o più gruppi -CH=) sono anche usati. Devono il loro colore alla presenza di un sistema coniugato. Un esempio di tale colorante è il C.I. Basic Yellow 28 che è una diazacianina:
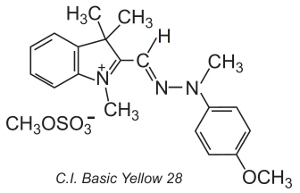
I coloranti sono spesso applicati in una soluzione di un elettrolita, che controlla la velocità di diffusione nella struttura della fibra, a temperature di circa 370 K.
(v) Coloranti dispersi
Questi coloranti sono essenzialmente idrofobici e sono quasi insolubili in acqua. Tuttavia hanno affinità per le fibre idrofobiche, per esempio i poliesteri, e vengono applicati come dispersioni molto fini in acqua (Tabella 4).
La maggior parte dei coloranti dispersi sono composti azoici e possono dare colori attraverso lo spettro. Alcuni sono coloranti a base di antrachinone per i rossi, i viola, i blu e i verdi.
Le fibre di poliestere possono essere tinte a 400 K sotto pressione, permettendo l’uso di strutture di coloranti di dimensioni molecolari maggiori che raggiungono una migliore solidità, per esempio:
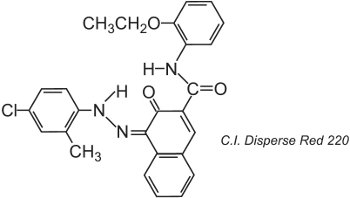
La struttura mostrata è il tautomero chetoidrazone.
Coloranti del gruppo 2
Anche se i coloranti di questo gruppo sono applicati con un processo a due fasi (che contrasta con il processo a una fase per i coloranti del gruppo 1), i coloranti hanno dei vantaggi, in particolare con la solidità.
i) Coloranti reattivi
I coloranti reattivi sono di straordinaria importanza per la tintura del cotone, permettendo una colorazione intensa e brillante con alta solidità. Circa il 95% dei coloranti reattivi sono coloranti azoici che coprono tutta la gamma di colori. I blu e i verdi sono forniti anche da strutture di antrachinone e ftalocianina.
Come suggerisce il nome di questi coloranti, essi reagiscono con la fibra, sia cellulosica (cotone) che proteica (lana) per formare legami covalenti (tabella 4). Le due fasi, prima la tintura, poi la reazione, possono avvenire separatamente o contemporaneamente. La caratteristica strutturale è la presenza di uno o più gruppi reattivi. Tipicamente i coloranti sono rappresentati come
D-B-RG
dove D è il cromogeno, B un gruppo ponte e RG il gruppo reattivo.
I gruppi reattivi più importanti sono le triazine clorurate e i vinilsolfoni.
Uno dei tre isomeri della triazina più semplice è:
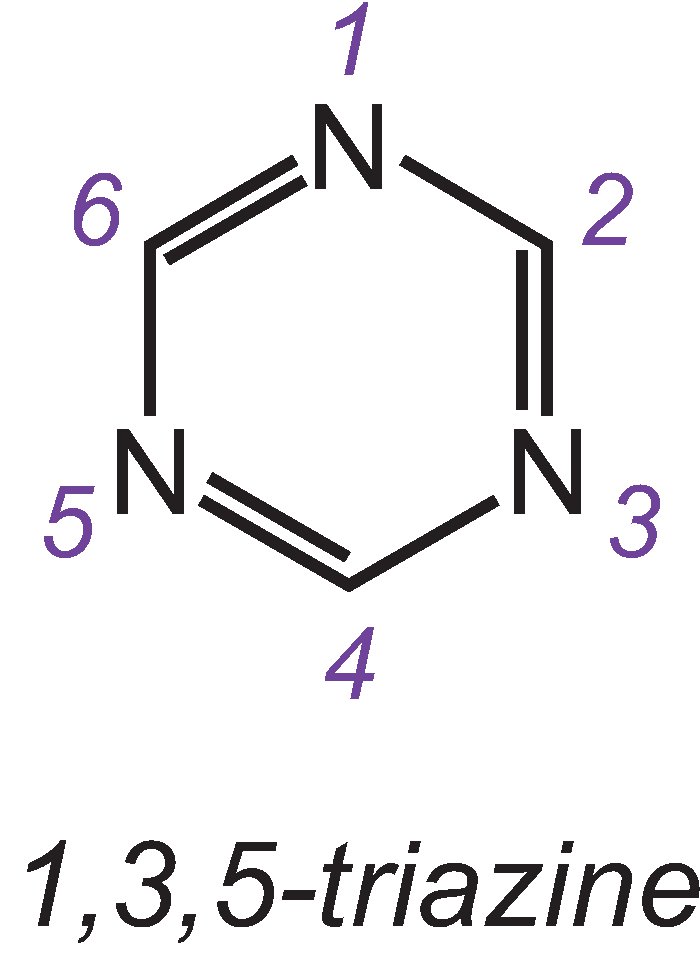
Un esempio di colorante con un gruppo diclorotriazina è C.I. Reactive Blue 109:
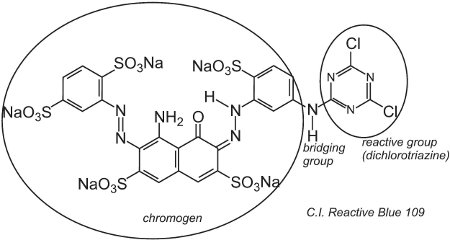
La reazione tra i gruppi -OH della cellulosa nella fibra e i gruppi -C-Cl nella clorotriazina avviene tramite una reazione di sostituzione (nucleofila) per formare legami covalenti.
Un etenile (vinile) solfone contiene il gruppo CH2=CHSO2 e il più semplice è il dietenilsulfone (divinilsulfone). Il gruppo solfone può essere visto nel C.I. Reactive Blue 19:
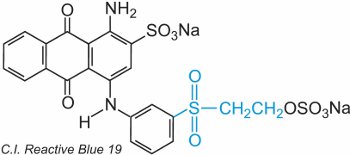
In questo esempio, non c’è un gruppo di collegamento.
Il colorante reagisce con la cellulosa per addizione al doppio legame zolfo-ossigeno.
I coloranti reattivi, nella soluzione acquosa, possono subire l’idrolisi del solfone rendendolo non reattivo alla cellulosa. Questo significa che il colorante non reagito, se non viene lavato via correttamente, rimarrà sulla superficie del tessuto dando un colore apparente che verrà lavato via nel tempo. Per ridurre questo problema, sono stati progettati coloranti con due diversi gruppi reattivi di diversa reattività. Questi coloranti offrono una migliore solidità perché se uno dei gruppi viene idrolizzato in soluzione, l’altro reagirà con i gruppi idrossilici nel tessuto. Il primo di questi comprendeva sia una clorotriazina che gruppi vinilsolfone e un esempio è il C.I. Reactive Red 194:
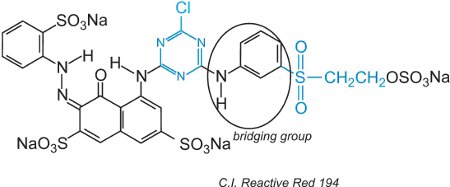
Oltre ai due diversi gruppi reattivi, c’è un cromogeno e un gruppo ponte.
Tutti i coloranti reattivi hanno una dimensione molecolare relativamente piccola e hanno anche due o più gruppi di acido solfonico nel cromogeno, portando a un’alta solubilità in acqua. Una parte delle specie di coloranti (anionici) non reagisce con la fibra e viene idrolizzata e il prodotto deve essere rimosso con il lavaggio.

Figura 3 I jeans vengono tinti con indaco e una varietà di coloranti allo zolfo, la scelta dipende dal colore desiderato.
Per gentile concessione di Lizzie Hubbard.
(ii) Coloranti al tino
Circa l’80% dei coloranti al tino appartiene alla classe chimica degli antrachinoni e copre l’intera gamma di colori. Un tipo, i coloranti indigoidi, comprende l’indaco:
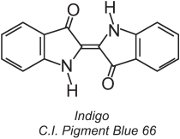
Tutti i coloranti al tino sono insolubili in acqua. Per applicarli su una fibra, per esempio il cotone, vengono messi in una soluzione alcalina (tabella 4). Il colorante insolubile si riduce per formare un anione incolore (leuco) che è solubile e possiede affinità per la fibra. Questo viene poi adsorbito dalla fibra, a volte in presenza di cloruro di sodio, condizioni simili a quelle dei coloranti diretti. Dopo il processo di tintura, il colorante originario insolubile viene rigenerato all’interno della fibra per ossidazione, di solito usando una soluzione di perossido di idrogeno o semplicemente aria:
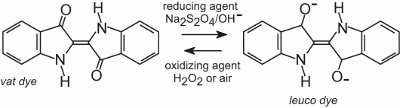
I coloranti sono insolubili nella struttura della fibra e quindi hanno una buona resistenza al lavaggio e possiedono anche un’elevata resistenza alla luce.
(iii) Coloranti a base di zolfo
I coloranti a base di zolfo, come i coloranti al tino, vengono applicati ai tessuti (cellulosa, tabella 4) in forma anionica solubile e poi ossidati nella forma insolubile.
C.I. Sulphur Black 1 e C.I. Sulphur Blue 7 sono tra i coloranti a base di zolfo più utilizzati. Come altri coloranti a base di zolfo, le loro strutture sono variabili e in gran parte sconosciute. Forniscono una gamma di neri, marroni e blu opachi. Sono comunque molto più economici dei coloranti al tino da produrre perché la loro preparazione, tramite riscaldamento di vari composti organici con zolfo, è semplice.
Pigmenti
I pigmenti sono usati nella colorazione di vernici, inchiostri da stampa, ceramiche e plastiche. Possono essere usati su una varietà molto più ampia di sostanze rispetto ai coloranti perché non dipendono dalla solubilità in acqua per la loro applicazione. Un pigmento è un solido finemente diviso che è essenzialmente insolubile nel suo mezzo di applicazione. Nella maggior parte dei casi, il pigmento viene aggiunto a un mezzo liquido, ad esempio una vernice bagnata o una termoplastica fusa. Il mezzo viene poi lasciato solidificare dall’evaporazione del solvente o dal raffreddamento e così le molecole del pigmento si fissano meccanicamente allo stato solido.
I cromofori usati nei pigmenti sono di solito gli stessi usati nei coloranti, ma i pigmenti sono molecole grandi e non hanno gruppi solubilizzanti. Contengono gruppi che formano legami intermolecolari che aiutano a ridurre la solubilità. Più grande è la molecola, più opaco è il pigmento.

| Figure 4 e 5 I coloranti rosso e giallo sono pigmenti azoici (C.I. Pigment Red 57 e C.I. Pigment Yellow 13). Il blu è il pigmento ftalocianina di rame. Per gentile concessione di BASF. |
 |
I pigmenti organici generalmente producono una maggiore intensità e luminosità del colore rispetto ai pigmenti inorganici come il giallo cromo (cromato di piombo(II)(VI)).
I pigmenti organici presentano una serie di proprietà di solidità che dipendono dalla struttura molecolare e dalla natura dell’associazione intramolecolare allo stato solido. Un aumento della dimensione molecolare di un pigmento generalmente diminuisce la solubilità del pigmento. Inoltre, molti pigmenti hanno il gruppo ammidico (-NHCO-) incorporato che ne diminuisce ulteriormente la solubilità poiché le molecole sono tenute insieme in grandi strutture dal legame idrogeno (tra il gruppo N-H in una molecola e un gruppo C=O in un’altra).
Molti pigmenti organici sono basati sulla chimica azoica e dominano le zone di tonalità gialla, arancione e rossa. Un esempio di un pigmento monoazo semplice è il C.I. Pigment Yellow 1:
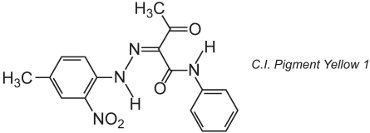
Questa forma è il tautomero chetoidrazonico.
Le ftalocianine di rame forniscono la maggior parte dei pigmenti blu e verdi. Sono strutturalmente complesse ma relativamente poco costose da produrre. Offrono un’eccellente resistenza alla luce, al calore, agli acidi e agli alcali.
Un esempio è C.I. Pigment Blue 15:
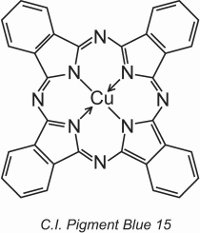
Prima nell’unità, la struttura di un colorante, C.I. Direct Blue 86, e si può vedere come i gruppi di acido solfonico in quella struttura trasformano un pigmento in un colorante.
Tinture e pigmenti funzionali (alta tecnologia)
Tinture e pigmenti funzionali sono prodotti in piccoli volumi rispetto ai composti usati per la tintura dei tessuti. Tuttavia, sono oggetto di molta ricerca e interesse e vengono sviluppati per una varietà di scopi. Alcuni di questi sono illustrati qui sotto.
(a) Display a cristalli liquidi
I cristalli liquidi hanno giocato un ruolo importante nella nostra vita per molti anni in varie forme di display informativi, per esempio nelle calcolatrici. Inizialmente potevano solo visualizzare le differenze tra luce e buio. Si è scoperto che usando coloranti questo contrasto poteva essere aumentato e si potevano produrre schermi colorati. Ora hanno ampiamente sostituito le tecnologie di visualizzazione tradizionali dei diodi emettitori di luce e dei tubi a raggi catodici. I coloranti utilizzati sono stati specificamente progettati per cambiare l’orientamento con le molecole dei cristalli liquidi e quindi offrono una maggiore intensità di colore. Questi coloranti sono detti dicroici.
(b) Coloranti laser
Il termine laser è un acronimo che si riferisce all’amplificazione della luce mediante emissione stimolata di radiazioni.
Comunemente venivano usati laser inorganici, ma avevano solo la capacità di produrre radiazioni a poche lunghezze d’onda selezionate e in bande molto strette. L’uso di coloranti ha permesso la produzione di luce in tutto lo spettro da lunghezze d’onda di 320 a 1200 nm. L’applicazione dei laser a coloranti include la tecnologia della comunicazione e la microchirurgia.
(c) Stampa a getto d’inchiostro
La stampa a getto d’inchiostro è una tecnica senza impatto per produrre immagini dirigendo piccole gocce di inchiostro, idealmente sotto il controllo del computer, in rapida successione su un substrato. Ha trovato molte applicazioni. A causa dei requisiti di dimensione delle gocce per poter ottenere una buona definizione, l’uso di coloranti è stato favorito rispetto ai pigmenti. Le gocce sono più piccole (i pigmenti tendono a bloccare gli ugelli) e la solubilità acquosa riduce l’impatto ambientale e mantiene basso il prezzo. I primi coloranti erano quelli già utilizzati in altre industrie, ma erano caratterizzati da una scarsa solidità all’acqua. Questo ha portato allo sviluppo di coloranti specifici e di sistemi fluidi unici. Questi coloranti sono progettati per essere solubili in sistemi leggermente alcalini (pH 7,5-10) che sono resi insolubili dalle condizioni leggermente acide (pH 4,5-6,5) sulla carta o su altri substrati. Questa tecnologia sta avendo un grande impatto sulla stampa industriale ad alto volume per imballaggi, tessuti, rivestimenti murali e display pubblicitari.
(d) Terapia fotodinamica
È un trattamento per il cancro che utilizza una combinazione di luce laser, un composto fotosensibilizzante (il colorante) e ossigeno molecolare. Il colorante viene somministrato al paziente per via endovenosa e col tempo entra nelle cellule cancerose. L’irradiazione delle cellule con la luce laser può iniziare la loro distruzione.
Il laser interagisce con il colorante e lo promuove al suo stato eccitato. Attraverso un processo complesso, vengono prodotte molecole di ossigeno eccitate (più reattive) che reagiscono con centri insaturi nelle proteine e nei lipidi della membrana cellulare. Questo metodo di trattamento evita l’uso di un intervento chirurgico invasivo.
.