Egyes atomok azért polárisabbak, mint mások, mert “mohóbbak” az elektronokra.
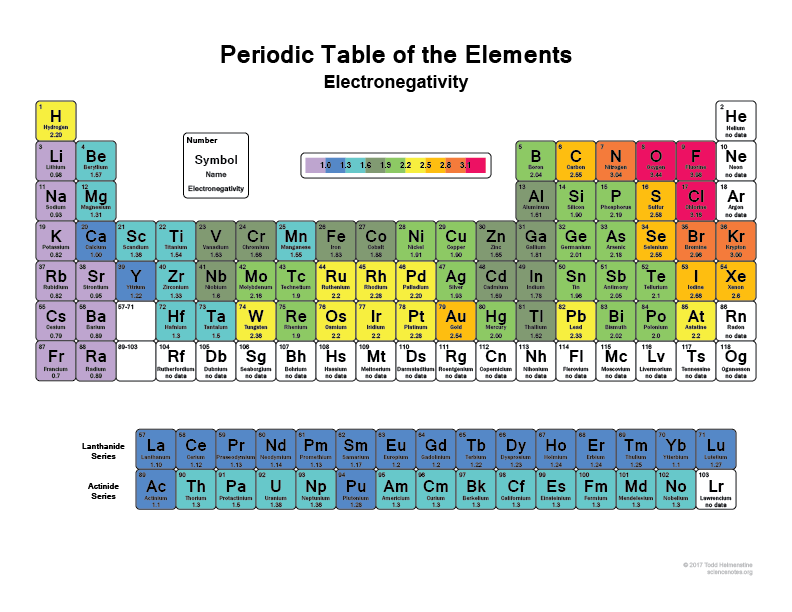
Nézd meg a periódusos rendszert, minél jobbra és feljebb mész, annál elektronegatívabbak lesznek az atomok (a nemesgázokat nem számítva, mert azoknak teljes héjuk van, “boldogok” és nincs szükségük valenciaelektronokra).
Gondolom mindenki hallotta már, hogy például a Flourin (F) az egyik legelektronegatívabb elem, szó szerint elektronokat szakít le a hidrogénatomokról vagy a szénatomokról. Akárcsak a klór (Cl)
Nézd meg ezt a képet:
Ez az oka annak, hogy amikor egy kötésnél egyes molekuláknak szuper poláris régiói vannak, mert valami olyasmi, mint a hidrogén kötődik valami olyasmivel, mint a liszt, ami alapvetően csak az elektronokat tartja magával a legtöbbször.
Ezt a kérdést meg lehet magyarázni az elektronfelhők gondolatával is, és azzal a ténnyel, hogy az elektronegatívabb atomoknál általában több elektron marad vele a legtöbbször, szemben a kevésbé elektronegatív atomokkal.

Ezt dipólusmomentumnak hívják, és anélkül, hogy túlságosan belemennénk, láthatjuk, hogy a legtöbb elektron közelebb van az oxigénhez, mint a hidrogénhez (mert az oxigén elektronegatívabb, mint a hidrogén)
Az elektronegatív szó egyébként néha ellentmondásosan hangzik, de a pozitív helyett elektornegatív, mert a kémiában az elektronokat nyert atomok negatív előjellel rendelkeznek (Pl.: #Cl^-# egy klór, amely nyert egy elektront).