Learning Objectives
- Wyjaśnij, dlaczego punkty wrzenia alkoholi są wyższe niż eterów i alkanów o podobnych masach molowych.
- Wyjaśnij, dlaczego alkohole i etery o czterech lub mniejszej liczbie atomów węgla są rozpuszczalne w wodzie, podczas gdy porównywalne alkany nie są rozpuszczalne.
Alkohole można uznać za pochodne wody (H2O; zapisywane również jako HOH).

Podobnie jak wiązanie H-O-H w wodzie, wiązanie R-O-H jest wygięte, a cząsteczki alkoholu są polarne. Zależność ta jest szczególnie widoczna w małych cząsteczkach i znajduje odzwierciedlenie we właściwościach fizycznych i chemicznych alkoholi o małej masie molowej. Zastąpienie atomu wodoru z alkanu grupą OH pozwala cząsteczkom łączyć się poprzez wiązanie wodorowe (Rysunek \(\PageIndex{1}}).
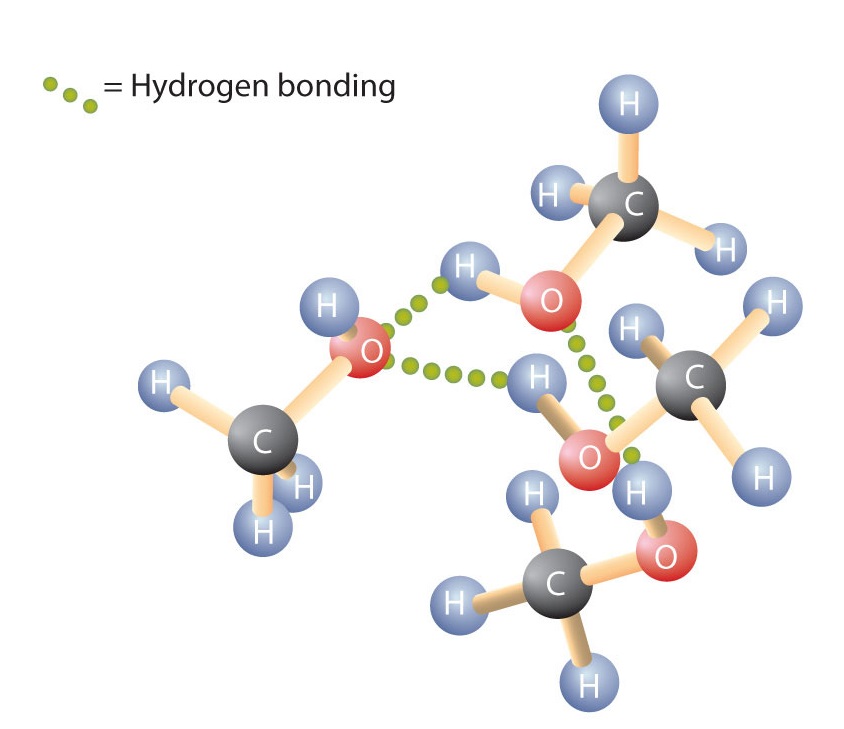
Przypomnijmy, że właściwości fizyczne są w dużym stopniu zdeterminowane przez rodzaj sił międzycząsteczkowych. W tabeli rzedstawiono masy molowe i temperatury wrzenia niektórych powszechnie występujących związków chemicznych. Tabela pokazuje, że substancje o podobnych masach molowych mogą mieć całkiem różne punkty wrzenia.
| Formula | Name | Molar Mass | Boiling Point (°C) | |
|---|---|---|---|---|
| CH4 | metan | 16 | -164 | |
| HOH | woda | 18 | 100 | |
| C2H6 | etan | 30 | -89 | |
| CH3OH | metanol | 32 | 65 | |
| C3H8 | propan | 44 | -42 | |
| CH3CH2OH | etanol | 46 | 78 | |
| C4H10 | butan | 58 | -1 | |
| CH3CH2CH2OH | 1-…propanol | 60 | 97 |
Alkany są niepolarne i dlatego wiążą się tylko poprzez stosunkowo słabe siły dyspersyjne. Alkany o liczbie atomów węgla od jednego do czterech są w temperaturze pokojowej gazami. W przeciwieństwie do nich, nawet metanol (z jednym atomem węgla) jest cieczą w temperaturze pokojowej. Wiązanie wodorowe znacznie podwyższa temperaturę wrzenia alkoholi w porównaniu z węglowodorami o porównywalnej masie molowej. Temperatura wrzenia jest przybliżoną miarą ilości energii potrzebnej do oddzielenia cząsteczki cieczy od jej najbliższych sąsiadów. Jeśli cząsteczki oddziałują ze sobą poprzez wiązanie wodorowe, to do przerwania tych międzycząsteczkowych atrakcji należy dostarczyć stosunkowo dużą ilość energii. Tylko wtedy cząsteczka może wydostać się z cieczy do stanu gazowego.
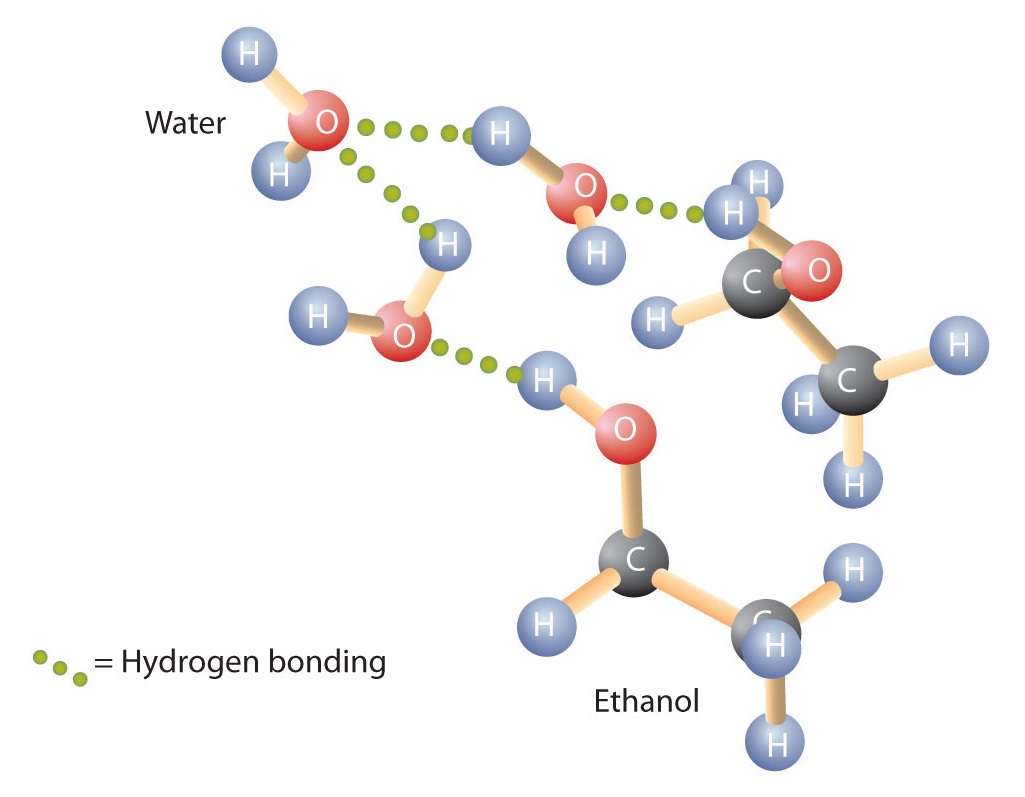
Alkohole mogą również angażować się w wiązanie wodorowe z cząsteczkami wody (rysunek \{2}). Tak więc, podczas gdy węglowodory są nierozpuszczalne w wodzie, alkohole z jednym do trzech atomów węgla są całkowicie rozpuszczalne. Jednak wraz ze wzrostem długości łańcucha rozpuszczalność alkoholi w wodzie maleje; cząsteczki stają się bardziej podobne do węglowodorów, a mniej do wody. Alkohol 1-dekanol (CH3CH2CH2CH2CH2CH2CH2CH2CH2OH) jest w zasadzie nierozpuszczalny w wodzie. Często spotykamy się z tym, że granica rozpuszczalności w rodzinie związków organicznych występuje przy czterech lub pięciu atomach węgla.
Podsumowanie
Alkohole mają wyższe temperatury wrzenia niż etery i alkany o podobnych masach molowych, ponieważ grupa OH pozwala cząsteczkom alkoholu angażować się w wiązanie wodorowe. Alkohole o czterech lub mniejszej liczbie atomów węgla są rozpuszczalne w wodzie, ponieważ cząsteczki alkoholu angażują się w wiązanie wodorowe z cząsteczkami wody; porównywalne cząsteczki alkanów nie mogą angażować się w wiązanie wodorowe.
Ćwiczenia sprawdzające pojęcia
-
Dlaczego etanol jest bardziej rozpuszczalny w wodzie niż 1-heksanol?
-
Dlaczego 1-butanol ma niższą temperaturę wrzenia niż 1-heksanol?
Odpowiedzi
-
Etanol ma grupę OH i tylko 2 atomy węgla; 1-heksanol ma jedną grupę OH na 6 atomów węgla i dlatego jest bardziej podobny do (niepolarnego) węglowodoru niż etanol.
-
Masa molowa 1-heksanolu jest większa niż masa molowa 1-butanolu.
Ćwiczenia
Odpowiedz na poniższe ćwiczenia bez korzystania z tabel w tekście.
-
Uszereguj te alkohole w kolejności rosnącej temperatury wrzenia: etanol, metanol i 1-propanol.
-
Który z alkoholi ma wyższą temperaturę wrzenia – butan czy 1-propanol?
-
Zestaw alkohole w kolejności rosnącej rozpuszczalności w wodzie: 1-butanol, metanol i 1-oktanol.
-
Uszereguj te związki w kolejności rosnącej rozpuszczalności w wodzie: 1-butanol, etanol i pentan.
Odpowiedzi
-
metanol < etanol < 1-.propanol
-
1-oktanol < 1-butanol < metanol
.