Learning Objectives
- Znać związek między siłą kwasu lub zasady a wielkością \(K_a\), \(K_b\), \(pK_a\), i \(pK_b\).
- Aby zrozumieć efekt poziomowania.
Wielkość stałej równowagi dla reakcji jonizacji może być użyta do określenia względnych sił kwasów i zasad. Na przykład, ogólne równanie jonizacji słabego kwasu w wodzie, gdzie HA jest kwasem macierzystym, a A- jest jego zasadą sprzężoną, jest następujące:
Stała równowagi dla tej dysocjacji jest następująca:
Jak zauważyliśmy wcześniej, stężenie wody jest zasadniczo stałe dla wszystkich reakcji zachodzących w roztworze wodnym, więc \(\) w równaniu \(\) można włączyć do nowej wielkości, stałej jonizacji kwasu (\(K_a\)), zwanej również stałą dysocjacji kwasu:
\(\)
Więc wartości liczbowe K i K_a różnią się o stężenie wody (55,3 M). Ponownie, dla uproszczenia, \(H_3O^+\) można zapisać jako \(H^+\) w równaniu \(\ref{16.5.3}}). Należy jednak pamiętać, że wolny ^+ ^) nie istnieje w roztworach wodnych i że proton jest przenoszony do ^2O ^) we wszystkich reakcjach jonizacji kwasów, tworząc jony hydroniowe ^3O^+ ^). Im większa stała K_a, tym mocniejszy jest kwas i tym większe jest stężenie H^+ w stanie równowagi. Jak wszystkie stałe równowagi, stałe jonizacji kwasowo-zasadowej są w rzeczywistości mierzone w kategoriach aktywności ^(H^+ lub ^(OH^-), co czyni je bezjednostkowymi. Wartości K_a dla wielu popularnych kwasów są podane w tabeli.
Słabe zasady reagują z wodą, wytwarzając jon wodorotlenkowy, jak pokazano w następującym ogólnym równaniu, gdzie B jest macierzystą zasadą, a BH+ jest jej sprzężonym kwasem:
Stała równowagi dla tej reakcji jest stałą jonizacji zasady (Kb), zwaną również stałą dysocjacji zasady:
\u2004\u2004\u2005\u2005\u2005
Ponownie, stężenie wody jest stałe, więc nie pojawia się w wyrażeniu stałej równowagi; zamiast tego jest uwzględnione w \(K_b\). Im większa wartość K_b, tym silniejsza zasada i tym wyższe stężenie OH^- w stanie równowagi. Wartości \(K_b\) dla kilku popularnych słabych zasad podano w tabeli \(\PageIndex{2}\).
Istnieje prosta zależność między wielkością \(K_a\) dla kwasu i \(K_b\) dla jego sprzężonej zasady. Rozważmy na przykład jonizację kwasu cyjanowodorowego (HCN) w wodzie w celu otrzymania roztworu kwasowego oraz reakcję kwasu cyjanowodorowego (CN^-) z wodą w celu otrzymania roztworu zasadowego:
Wyrażenie stałej równowagi dla jonizacji HCN jest następujące:
}{}.
Odpowiednie wyrażenie dla reakcji cyjanku z wodą jest następujące:
}{}
Jeśli dodamy równania \(\{16.5.6}} i \(\{16.5. \\ H^+_{(aq)} + \cancel{CN^-_{(aq)} \\}
W tym przypadku, suma reakcji opisanych przez \(K_a\) i \(K_b\) jest równaniem autojonizacji wody, a iloczyn tych dwóch stałych równowagi to \(K_w\):
Tak więc, jeśli znamy albo \(K_a\) dla kwasu, albo \(K_b\) dla jego sprzężonej zasady, możemy obliczyć drugą stałą równowagi dla dowolnej sprzężonej pary kwas-zasada.
Tak jak w przypadku \(pH\), \(pOH\) i pKw, możemy użyć ujemnych logarytmów, aby uniknąć notacji wykładniczej w zapisie stałych jonizacji kwasów i zasad, definiując \(pK_a\) w następujący sposób:
oraz \(pK_b\) jako
Podobnie, równanie \(\ref{16.5.10}), które wyraża zależność między \(K_a\) i \(K_b\), można zapisać w postaci logarytmicznej w następujący sposób:
W temperaturze 25 °C, to staje się
Wartości \(pK_a\) i \(pK_b\) są podane dla kilku popularnych kwasów i zasad w tabelach \(\PageIndex{1}\) i \(\PageIndex{2}\), odpowiednio, a szerszy zestaw danych znajduje się w tabelach E1 i E2. Ze względu na użycie logarytmów ujemnych, mniejsze wartości pK_a odpowiadają większym stałym jonizacji kwasów, a tym samym silniejszym kwasom. Na przykład, kwas azotowy (HNO_2), o stałej jonizacji 3,25, jest około milion razy silniejszym kwasem niż kwas cyjanowodorowy (HCN), o stałej jonizacji 9,21. I odwrotnie, mniejsze wartości \(pK_b\) odpowiadają większym stałym jonizacji zasad, a więc silniejszym zasadom.
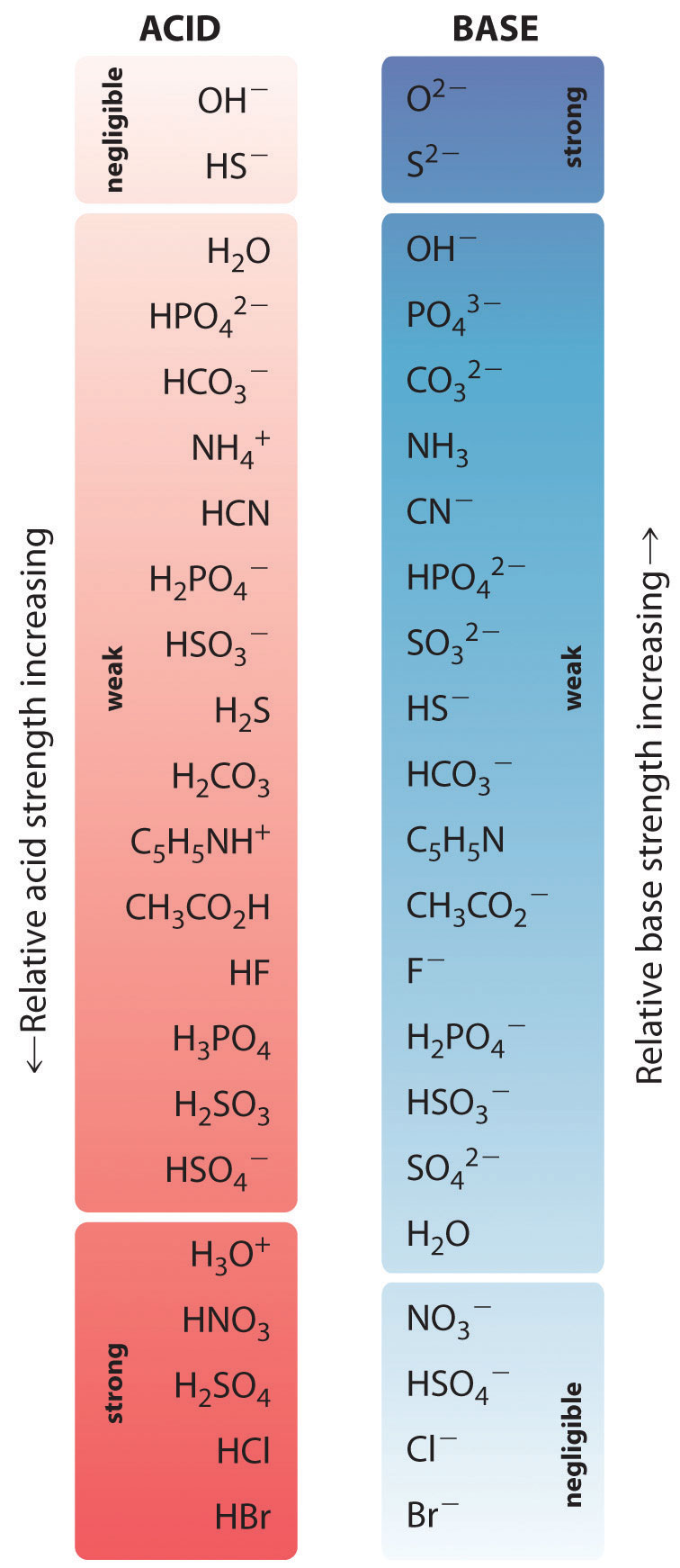
Względne mocne strony niektórych popularnych kwasów i ich sprzężonych zasad pokazano graficznie na rysunku \(\PageIndex{1}}). Sprzężone pary kwas-zasada są wymienione w kolejności (od góry do dołu) rosnącej siły kwasu, co odpowiada malejącym wartościom pK_a. Kolejność ta odpowiada malejącej sile zasady sprzężonej lub rosnącym wartościom ∗(pK_b). Na dole po lewej stronie rysunku znajdują się najczęściej występujące mocne kwasy, a na górze po prawej najczęściej występujące mocne zasady. Zwróć uwagę na odwrotną zależność pomiędzy siłą kwasu macierzystego a siłą zasady sprzężonej. Tak więc sprzężona zasada mocnego kwasu jest bardzo słabą zasadą, a sprzężona zasada bardzo słabego kwasu jest mocną zasadą.
Sprzężona zasada mocnego kwasu jest słabą zasadą i odwrotnie.
Możemy użyć względnych mocy kwasów i zasad, aby przewidzieć kierunek reakcji kwasowo-zasadowej, stosując się do jednej zasady: równowaga kwasowo-zasadowa zawsze faworyzuje stronę ze słabszym kwasem i zasadą, jak wskazują te strzałki:
W reakcji kwasowo-zasadowej proton zawsze reaguje z silniejszą zasadą.
Na przykład, kwas chlorowodorowy jest silnym kwasem, który jonizuje się zasadniczo całkowicie w rozcieńczonym roztworze wodnym, tworząc \(H_3O^+\) i \(Cl^-\); tylko znikome ilości cząsteczek \(HCl\) pozostają niezdysocjowane. Stąd równowaga jonizacji leży praktycznie całkowicie po prawej stronie, co przedstawia pojedyncza strzałka:
Z kolei kwas octowy jest słabym kwasem, a woda słabą zasadą. W związku z tym wodne roztwory kwasu octowego zawierają głównie cząsteczki kwasu octowego w równowadze z niewielkim stężeniem jonów wodorotlenowych i octanowych, a równowaga jonizacji leży daleko po lewej stronie, co przedstawiają te strzałki:
Podobnie w reakcji amoniaku z wodą jon wodorotlenowy jest silną zasadą, a amoniak słabą zasadą, natomiast jon amonowy jest silniejszym kwasem niż woda. Stąd ta równowaga również leży po lewej stronie:
Wszystkie równowagi kwasowo-zasadowe faworyzują stronę ze słabszym kwasem i zasadą. W ten sposób proton jest związany z silniejszą zasadą.
Przykład: Butyrate and Dimethylammonium Ions
- Oblicz \(K_b\) i \(pK_b\) jonu maślanowego (\(CH_3CH_2CH_2CO_2^-\)). Wartość pK_a kwasu masłowego w temperaturze 25°C wynosi 4,83. Kwas masłowy jest odpowiedzialny za nieprzyjemny zapach zjełczałego masła.
- Oblicz \(K_a\) i \(pK_a\) jonu dimetyloamoniowego (\((CH_3)_2NH_2^+\)). Podstawowa stała jonizacji \(K_b\) dimetyloaminy (\((CH_3)_2NH\)) wynosi \(5,4 \ razy 10^{-4}} w temperaturze 25°C.
Dane: \(pK_a\) i \(K_b\)
Pytanie o: odpowiednie \(K_b\) i \(pK_b\), \(K_a\) i \(pK_a\)
Strategia:
Stałe \(K_a\) i \(K_b\) są powiązane jak pokazano w równaniu \(\ref{16.5.10}\). Stałe \(pK_a\) i \(pK_b\) dla kwasu i jego sprzężonej zasady są powiązane, jak pokazano w równaniach \(\ref{16.5.15}} i \(\ref{16.5.16}}. Użyj zależności pK = -log K i K = 10-pK (równania \(\ref{16.5.11}} i \(\ref{16.5.13}}) do konwersji między \(K_a) i \(pK_a) lub \(K_b) i \(pK_b).
Rozwiązanie:
Podajemy \(pK_a\) dla kwasu masłowego i prosimy o obliczenie \(K_b\) i \(pK_b\) dla jego sprzężonej zasady, jonu maślanowego. Ponieważ podana wartość \(pK_a\) dotyczy temperatury 25°C, możemy skorzystać z równania \(\ref{16.5.16}}): \(pK_a\) + \(pK_b\) = pKw = 14,00. Podstawiając \(pK_a\) i rozwiązując dla \(pK_b\),
Ponieważ \(pK_b = -log K_b\), \(K_b\) jest \(10^{-9,17} = 6,8 \ razy 10^{-10}\).
W tym przypadku otrzymujemy \(K_b\) dla zasady (dimetyloaminy) i mamy obliczyć \(K_a\) i \(pK_a\) dla jej sprzężonego kwasu, jonu dimetyloamoniowego. Ponieważ podaną wielkością początkową jest \(K_b\), a nie \(pK_b\), możemy skorzystać z równania \(\ref{16.5.10}}): \(K_aK_b = K_w\). Podstawiając wartości \(K_b\) i \(K_w\) w 25°C i rozwiązując dla \(K_a\),
Ponieważ \(pK_a\) = -log \(K_a\), mamy \(pK_a = -log(1,9 \ razy 10^{-11}) = 10,72). Mogliśmy również przekształcić \(K_b\) na \(pK_b\), aby uzyskać tę samą odpowiedź:
Jeśli otrzymamy dowolną z tych czterech wielkości dla kwasu lub zasady (\(K_a\), \(pK_a\), \(K_b\) lub \(pK_b\)), możemy obliczyć pozostałe trzy.
Ćw: Lactic Acid
Kwas mlekowy (\(CH_3CH(OH)CO_2H\) jest odpowiedzialny za ostry smak i zapach kwaśnego mleka; uważa się również, że wywołuje bolesność zmęczonych mięśni. Jego Ω (pK_a) wynosi 3,86 w temperaturze 25°C. Oblicz ∗(K_a) dla kwasu mlekowego oraz ∗(pK_b) i ∗(K_b) dla jonu mleczanowego.
Odpowiedź
- (K_a = 1,4 ∗ razy 10^{-4}}) dla kwasu mlekowego;
- (pK_b) = 10.14 i
- (K_b = 7.2 ^times 10^{-11}}) dla jonu mleczanowego
Solutions of Strong Acids and Bases: The Leveling Effect
W tabeli zauważysz, że kwasy takie jak \(H_2SO_4\) i \(HNO_3\) leżą powyżej jonu hydroniowego, co oznacza, że mają wartości \(pK_a\) mniejsze od zera i są silniejszymi kwasami niż jon \(H_3O^+). Przypomnijmy sobie z rozdziału 4, że kwaśny proton w praktycznie wszystkich kwasach tlenowych jest związany z jednym z atomów tlenu w oksoanionie. Tak więc kwas azotowy powinien być poprawnie zapisany jako \(HONO_2\). Niestety jednak, wzory kwasów tlenowych są prawie zawsze zapisywane z wodorem po lewej stronie i tlenem po prawej, co powoduje, że kwas azotowy ma postać HNO_3. W rzeczywistości wszystkie sześć popularnych mocnych kwasów, z którymi zetknęliśmy się po raz pierwszy w rozdziale 4, ma wartości pK_a mniejsze od zera, co oznacza, że mają one większą tendencję do utraty protonu niż jon HNO. I odwrotnie, zasady sprzężone tych mocnych kwasów są słabszymi zasadami niż woda. W związku z tym równowagi przenoszenia protonów dla tych mocnych kwasów leżą daleko na prawo, a dodanie któregokolwiek z powszechnie stosowanych mocnych kwasów do wody powoduje zasadniczo stechiometryczną reakcję kwasu z wodą, w wyniku której powstaje roztwór jonu H_3O^+ i sprzężonej zasady kwasu.
Ale chociaż K_a dla HI jest o 108 większe niż K_a dla HNO_3, reakcja HNO_3 lub HNO_3 z wodą daje zasadniczo stechiometryczny roztwór H_3O^+ i I- lub NO_3^-. W rzeczywistości, 0,1 M wodny roztwór dowolnego mocnego kwasu zawiera 0,1 M \(H_3O^+\), niezależnie od tożsamości mocnego kwasu. Zjawisko to nazywamy efektem wyrównywania: każdy gatunek kwasu, który jest mocniejszy niż sprzężony kwas wody (H_3O^+), jest w roztworze wodnym zrównany z mocą H_3O^+, ponieważ H_3O^+ jest najsilniejszym kwasem, który może istnieć w równowadze z wodą. W związku z tym, niemożliwe jest rozróżnienie między mocami kwasów takich jak HI i HNO3 w roztworze wodnym, a alternatywne podejście musi być stosowany do określenia ich względnej siły kwasu.
Jedną z metod jest użycie rozpuszczalnika, takiego jak bezwodny kwas octowy. Ponieważ kwas octowy jest silniejszym kwasem niż woda, musi być również słabszą zasadą, z mniejszą tendencją do przyjmowania protonu niż H_2O. Pomiary przewodnictwa 0,1 M roztworów zarówno HI jak i HNO w kwasie octowym pokazują, że HI jest całkowicie zdysocjowany, ale HNO jest tylko częściowo zdysocjowany i zachowuje się w tym rozpuszczalniku jak słaby kwas. Ten wynik wyraźnie mówi nam, że HI jest silniejszym kwasem niż HNO. Względna kolejność sił kwasów i przybliżone wartości \(K_a\) i \(pK_a\) dla silnych kwasów w górnej części tabeli \(\PageIndex{1}} zostały określone przy użyciu pomiarów takich jak ten i różnych rozpuszczalników niewodnych.
W roztworach wodnych, \(H_3O^+\) jest najsilniejszym kwasem, a \(OH^-\) jest najsilniejszą zasadą, która może istnieć w równowadze z \(H_2O\).
Efekt wyrównywania dotyczy również roztworów silnych zasad: W roztworze wodnym każda zasada silniejsza od OH- jest wyrównana do siły OH-, ponieważ OH- jest najsilniejszą zasadą, która może istnieć w równowadze z wodą. Sole takie jak \(K_2O \), \(NaOCH_3 \) (metotlenek sodu) i \(NaNH_2 \) (sodamid lub amid sodu), których aniony są sprzężonymi zasadami gatunków, które leżałyby poniżej wody w tabeli \(\PageIndex{2} \), są silnymi zasadami, które reagują zasadniczo całkowicie (i często gwałtownie) z wodą, przyjmując proton, aby dać roztwór \(OH^- \) i odpowiadający mu kation:
Innymi przykładami, z którymi możesz się spotkać, są wodorek potasu (\(KH\)) i związki metaloorganiczne, takie jak metylolit (\(CH_3Li\)).
Kwasy i zasady poliprotonowe
Jak się dowiedziałeś, kwasy poliprotonowe, takie jak \(H_2SO_4\), \(H_3PO_4\) i \(H_2CO_3\) zawierają więcej niż jeden jonizowalny proton, a protony są tracone w sposób stopniowy. W pełni protonowany gatunek jest zawsze najsilniejszym kwasem, ponieważ łatwiej jest usunąć proton z obojętnej cząsteczki niż z ujemnie naładowanego jonu. Tak więc siła kwasu maleje wraz z utratą kolejnych protonów, a co za tym idzie, wzrasta jego Ω (pK_a). Rozważmy na przykład:
Równowaga w pierwszej reakcji leży daleko po prawej stronie, co jest zgodne z tym, że H_2SO_4 jest mocnym kwasem. Natomiast w drugiej reakcji w stanie równowagi występują znaczne ilości zarówno kwasu (HSO_4^-), jak i kwasu (SO_4^{2-}}).
W przypadku kwasu poliprotonowego siła kwasu maleje, a wartość pK_a wzrasta wraz z kolejnymi utratami każdego protonu.
Jon siarkowodorowy (HSO_4^-)) jest zarówno zasadą sprzężoną z zasadą (H_2SO_4), jak i kwasem sprzężonym z zasadą (SO_4^{2-}}). Podobnie jak woda, HSO4- może więc działać jako kwas lub zasada, w zależności od tego, czy drugi reagent jest silniejszym kwasem czy silniejszą zasadą. I odwrotnie, jon siarczanowy (SO_4^{2-}}) jest zasadą poliprotonową, która może przyjąć dwa protony w sposób stopniowy:
Podobnie jak w przypadku każdej innej sprzężonej pary kwas-zasada, stężenia sprzężonych kwasów i zasad są powiązane przez \(pK_a\) + \(pK_b\) = pKw. Rozważmy, na przykład, parę sprzężonych kwasów i zasad ∙(HSO_4^-/ SO_4^{2-}}). Z tabeli widzimy, że pK_a \(HSO_4^- \) wynosi 1,99. Stąd pK_b dla siarczanu (SO_4^{2-}}) wynosi 14,00 – 1,99 = 12,01. Tak więc siarczan jest raczej słabą zasadą, podczas gdy β-(OH^-) jest mocną zasadą, więc równowaga przedstawiona w równaniu β-(^16.6}) leży po lewej stronie. Jon ®(HSO_4^-) jest również bardzo słabą zasadą (®(pK_a) ®(H_2SO_4) = 2,0, ®(pK_b) ®(HSO_4^- = 14 – (-2,0) = 16)), co jest zgodne z tym, czego oczekujemy od sprzężonej zasady silnego kwasu.
Przykład
Przewidź, czy równowaga dla każdej reakcji leży po lewej czy po prawej stronie, jak napisano.
- (NH^+_{4(aq)}+PO^{3-}_{4(aq)} \rightleftharpoons NH_{3(aq)}+HPO^{2−}_{4(aq)}\)
- \(CH_3CH_2CO_2H_{(aq)}+CN^−_{(aq)} \______________________________________________________________________________________________(CH_3CH_2CO^-_{2(aq)}+HCN_{(aq)})
Dane: zrównoważone równanie chemiczne
Pytanie o: położenie równowagi
Strategia:
Zidentyfikuj sprzężone pary kwas-zasada w każdej reakcji. Następnie zapoznaj się z tabelami i rysunkiem, aby określić, który z nich jest silniejszym kwasem, a który zasadą. Równowaga zawsze sprzyja tworzeniu się słabszej pary kwas-zasada.
Rozwiązanie:
Sprzężone pary kwas-zasada to \(NH_4^+/NH_3\) i \(HPO_4^{2-}/PO_4^{3-}). Zgodnie z tabelami \(\PageIndex{1}} i \(\PageIndex{2}}, \(NH_4^+\) jest silniejszym kwasem (\(pK_a = 9.25)) niż HPO_4^{2-}) (pKa = 12,32), a PO_4^{3-}) jest mocniejszą zasadą (pK_b = 1,68) niż NH_3) (pK_b = 4,75). Równowaga będzie więc leżeć po prawej stronie, sprzyjając tworzeniu się słabszej pary kwas-zasada:
Sprzężone pary kwas-zasada to \(CH_3CH_2CO_2H/CH_3CH_2CO_2^-\) i \(HCN/CN^-\). Zgodnie z tabelą, HCN jest słabym kwasem (pKa = 9,21), a CN^- jest umiarkowanie słabą zasadą (pKb = 4,79). Kwas propionowy (CH_3CH_2CO_2H) nie jest jednak wymieniony w tabeli \(\PageIndex{1}). W takiej sytuacji najlepszym rozwiązaniem jest poszukanie podobnego związku, którego właściwości kwasowo-zasadowe są wymienione. Na przykład, kwas propionowy i kwas octowy są identyczne z wyjątkiem grup przyłączonych do atomu węgla kwasu karboksylowego (\(\ce{-CH_2CH_3}\) versus \(\ce{-CH_3}\), więc możemy oczekiwać, że te dwa związki będą miały podobne właściwości kwasowo-zasadowe. W szczególności, moglibyśmy oczekiwać, że \(pK_a\) kwasu propionowego będzie podobnej wielkości jak \(pK_a\) kwasu octowego. (W rzeczywistości, \(pK_a\) kwasu propionowego wynosi 4,87, w porównaniu do 4,76 dla kwasu octowego, co sprawia, że kwas propionowy jest nieco słabszym kwasem niż kwas octowy). Zatem kwas propionowy powinien być kwasem znacznie silniejszym od kwasu Ω(HCN). Ponieważ silniejszy kwas tworzy słabszą zasadę sprzężoną, przewidujemy, że cyjanek będzie silniejszą zasadą niż propionian. Równowaga będzie więc leżeć po prawej stronie, sprzyjając powstawaniu słabszej pary kwas-zasada:
Ćwiczenie ∗
Przewiduj, czy równowaga dla każdej reakcji leży po lewej, czy po prawej stronie, jak napisano.
- (H_2O_{(l)}+HS^-_{(aq)} \rightleftharpoons OH^−_{(aq)}+H_2S_{(aq)}\)
- \(HCO^−_{2(aq)}+HSO^−_{4(aq)} \HCO_2H_{(aq)}+SO^{2-}_{4(aq)})
Odpowiedź a
lewa
Odpowiedź b
lewa
Podsumowanie
Reakcje kwasowo-zasadowe zawsze zawierają dwie sprzężone pary kwas-zasada. Każdy kwas i każda zasada mają przypisaną stałą jonizacji, która odpowiada ich sile kwasowej lub zasadowej. Dwa gatunki, które różnią się tylko protonem stanowią sprzężoną parę kwas-zasada. Wielkość stałej równowagi dla reakcji jonizacji może być użyta do określenia względnej mocy kwasów i zasad. Dla wodnego roztworu słabego kwasu, stała dysocjacji nazywana jest stałą jonizacji kwasu (K_a). Analogicznie, stała równowagi dla reakcji słabej zasady z wodą to stała jonizacji zasady (K_b). Dla dowolnej sprzężonej pary kwas-zasada, \(K_aK_b = K_w\). Mniejsze wartości pK_a odpowiadają większym stałym jonizacji kwasów, a tym samym silniejszym kwasom. I odwrotnie, mniejsze wartości \(pK_b\) odpowiadają większym stałym jonizacji zasad, a tym samym silniejszym zasadom. W temperaturze 25°C, \(pK_a + pK_b = 14,00\). Reakcje kwas-zasada przebiegają zawsze w kierunku, w którym powstaje słabsza para kwas-zasada. W roztworze wodnym nie może istnieć kwas mocniejszy niż H_3O^+ i zasada mocniejsza niż OH^-, co prowadzi do zjawiska zwanego efektem niwelacji. Kwasy (i zasady) poliprotonowe tracą (i zyskują) protony w sposób stopniowy, przy czym całkowicie protonowany gatunek jest najsilniejszym kwasem, a całkowicie zdeprotonowany gatunek najsilniejszą zasadą.
Kluczowe równania
- Stała jonizacji kwasu: ∗ ∗dfrac{}{}
- Zasadowa stała jonizacji: \= \dfrac{}{} \]
- Zależność między \(K_a\) i \(K_b\) sprzężonej pary kwas-zasada: ∗
- Definicja ∗ (pK_a): \ \
- Definicja \(pK_b\): \
- Zależność między \(pK_a\) i \(pK_b\) sprzężonej pary kwas-zasada: \
Współautorzy i przypisy
-
Stephen Lower, Professor Emeritus (Simon Fraser U.) Chem1 Virtual Textbook
.