Entropia
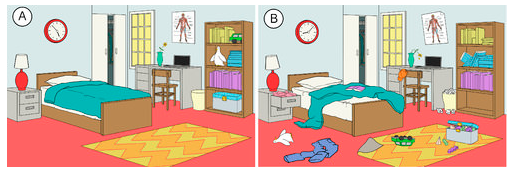
W naturze istnieje tendencja systemów do postępu w kierunku stanu większego nieuporządkowania lub przypadkowości. Entropia jest miarą stopnia przypadkowości lub nieuporządkowania systemu. Entropia jest pojęciem łatwym do zrozumienia, gdy myślimy o codziennych sytuacjach. Entropia w pokoju, który został niedawno posprzątany i zorganizowany jest niska. W miarę upływu czasu będzie on prawdopodobnie stawał się coraz bardziej nieuporządkowany, a zatem jego entropia będzie rosła (patrz rysunek poniżej). Naturalną tendencją systemu jest wzrost jego entropii.
Reakcje chemiczne również mają tendencję do przebiegania w taki sposób, aby zwiększać całkowitą entropię układu. Jak można stwierdzić, czy dana reakcja wykazuje wzrost czy spadek entropii? Pewnych wskazówek dostarcza stan molekularny reagentów i produktów. Poniższe przypadki ogólne ilustrują entropię na poziomie molekularnym.
- Dla danej substancji entropia stanu ciekłego jest większa niż entropia stanu stałego. Podobnie, entropia gazu jest większa niż entropia cieczy. Dlatego entropia wzrasta w procesach, w których stałe lub ciekłe reagenty tworzą produkty gazowe. Entropia wzrasta również wtedy, gdy stałe reagenty tworzą produkty ciekłe.
- Entropia wzrasta, gdy substancja zostaje rozbita na wiele części. Proces rozpuszczania zwiększa entropię, ponieważ cząsteczki solutu oddzielają się od siebie, gdy powstaje roztwór.
- Entropia wzrasta wraz ze wzrostem temperatury. Wzrost temperatury oznacza, że cząsteczki substancji mają większą energię kinetyczną. Szybciej poruszające się cząsteczki mają więcej nieuporządkowania niż cząsteczki poruszające się wolniej w niższej temperaturze.
- Entropia ogólnie wzrasta w reakcjach, w których całkowita liczba cząsteczek produktu jest większa niż całkowita liczba cząsteczek reagenta. Wyjątkiem od tej reguły jest sytuacja, w której z reagentów nie będących gazami powstaje gaz.
Poniższe przykłady posłużą do zilustrowania, w jaki sposób można przewidzieć zmianę entropii w reakcji.
(^ce{Cl_2} \left( g \right) \rightarrow \ce{Cl_2} \entropia maleje, ponieważ gaz staje się cieczą.
(^CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right)\)
Enstropia rośnie, ponieważ powstaje gaz i rośnie liczba cząsteczek.
(\ce{N_2} \left( g \right) + 3 \ce{H_2} \left( g \rightarrow) \rightarrow 2 \ce{NH_3}
Antropia maleje, ponieważ cztery całkowite cząsteczki reagentów tworzą dwie całkowite cząsteczki produktu. Wszystkie są gazami.
(^ce{AgNO_3} ∗ lewa strona( aq ∗ prawa strona) + ∗NaCl} \left( aq \rightarrow \ce{NaNO_3} \left( aq \right) + \ce{AgCl} \entropia maleje, ponieważ z wodnych reagentów powstaje ciało stałe.
(^H_2} \left( g \right) + \ce{Cl_2} \left( g \right) \rightarrow 2 \ce{HCl}
Zmiana entropii jest nieznana (ale prawdopodobnie nie zerowa), ponieważ po obu stronach równania znajduje się taka sama liczba cząsteczek i wszystkie są gazami.