Model Atomowy
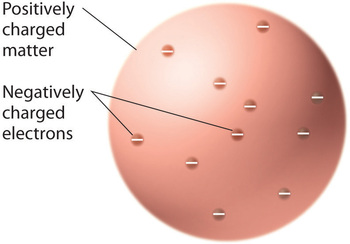
Odkąd naukowcy doszli do wniosku, że cała materia zawiera ujemnie naładowane elektrony, stało się jasne, że atomy, które są elektrycznie neutralne, muszą również zawierać dodatnie ładunki, aby zrównoważyć te ujemne. Thomson zaproponował, że elektrony były osadzone w jednolitej kuli, która zawierała zarówno ładunek dodatni jak i większość masy atomu, podobnie jak rodzynki w budyniu śliwkowym lub wiórki czekoladowe w ciasteczku (Rysunek \(\PageIndex{9}})
2.4.6
Rysunek \(\PageIndex{9}}: Thomson’s Plum Pudding or Chocolate Chip Cookie Model of the Atom. W tym modelu elektrony są osadzone w jednolitej sferze o ładunku dodatnim. Obraz użyty za pozwoleniem (CC BY-SA-NC).
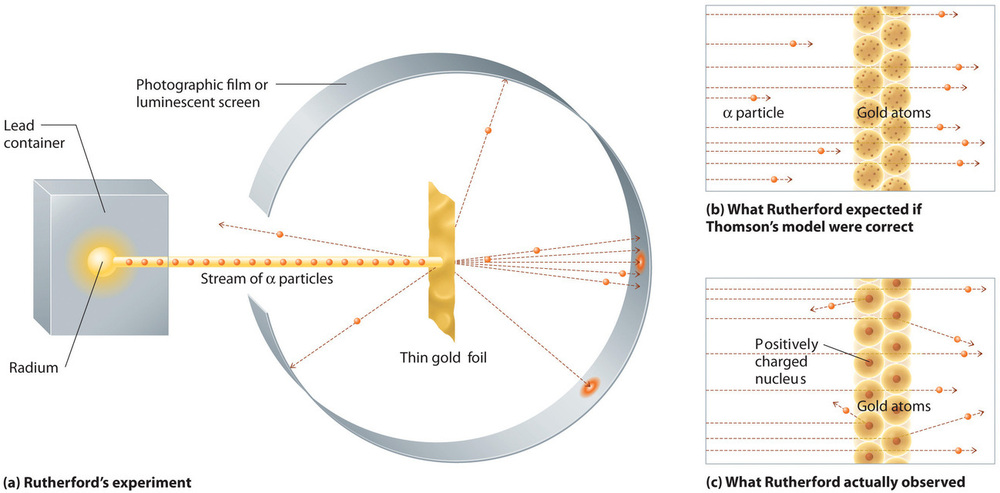
W jednym słynnym eksperymencie Rutherford pokazał jednak jednoznacznie, że model atomu Thomsona był błędny. Rutherford wycelował strumień cząstek α w bardzo cienką złotą folię (Rysunek 1) i zbadał jak cząstki α są rozpraszane przez folię. Złoto zostało wybrane, ponieważ można je łatwo młotkować na bardzo cienkie arkusze, co minimalizuje liczbę atomów w tarczy. Gdyby model atomu Thomsona był poprawny, dodatnio naładowane cząstki α powinny przebijać się przez równomiernie rozłożoną masę złotej tarczy jak kule armatnie przez drewnianą ścianę domu. Mogłyby poruszać się nieco wolniej, ale powinny przejść w zasadzie prosto przez tarczę (Rysunek \(\PageIndex{10b}}) Ku zdumieniu Rutherforda, niewielka część cząstek α została odchylona pod dużymi kątami, a niektóre zostały odbite bezpośrednio z powrotem do źródła (Rysunek \(\PageIndex{10c}}). Według Rutherforda, „Było to prawie tak niesamowite, jakbyś wystrzelił 15-calowy pocisk w kawałek bibuły, a on wrócił i uderzył cię.”
2.4.7
Rysunek \(\PageIndex{10}}}): Podsumowanie eksperymentów Rutherforda. (a) Przedstawienie aparatury, której Rutherford używał do wykrywania odchyleń w strumieniu cząstek α skierowanych na cel z cienkiej złotej folii. Cząstki te były wytwarzane przez próbkę radu. (b) Gdyby model atomu Thomsona był poprawny, cząstki α powinny były przejść prosto przez złotą folię. (c) Jednak niewielka liczba cząstek α została odchylona w różnych kierunkach, w tym także z powrotem do źródła. Mogło to być prawdą tylko wtedy, gdyby ładunek dodatni był znacznie masywniejszy niż cząstka α. Sugerowało to, że masa atomu złota jest skoncentrowana w bardzo małym obszarze przestrzeni, który nazwał jądrem. Obraz użyty za pozwoleniem (CC BY-SA-NC).
Wyniki Rutherforda nie były zgodne z modelem, w którym masa i ładunek dodatni są rozłożone równomiernie w całej objętości atomu. Zamiast tego, silnie sugerowały, że zarówno masa jak i ładunek dodatni są skoncentrowane w niewielkim ułamku objętości atomu, który Rutherford nazwał jądrem. Miało to sens, że niewielka część cząstek α zderzała się z gęstymi, dodatnio naładowanymi jądrami w sposób albo rażący, powodując duże odchylenia, albo prawie na wprost, powodując ich odbicie z powrotem do źródła.
 2.4.8
2.4.8
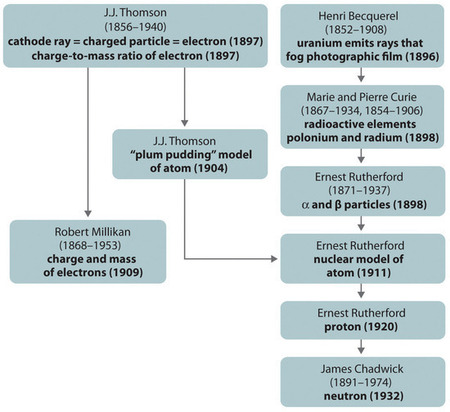
Figure \(\PageIndex{11}\): Podsumowanie Historycznego Rozwoju Modeli Składników i Struktury Atomu. Daty w nawiasach to lata, w których przeprowadzono kluczowe eksperymenty. Obraz użyty za pozwoleniem (CC BY-SA-NC).
Historyczny rozwój różnych modeli struktury atomu jest podsumowany w (Rysunek \(\PageIndex{11}}) Rutherford ustalił, że jądro atomu wodoru jest dodatnio naładowaną cząstką, dla której w 1920 roku ukuł nazwę proton. Zasugerował również, że jądra pierwiastków innych niż wodór muszą zawierać elektrycznie neutralne cząstki o mniej więcej takiej samej masie jak proton. Neutron został jednak odkryty dopiero w 1932 r., kiedy odkrył go James Chadwick (1891-1974, uczeń Rutherforda; Nagroda Nobla w dziedzinie fizyki, 1935). W wyniku prac Rutherforda stało się jasne, że cząstka α zawiera dwa protony i neutrony, a zatem jest jądrem atomu helu.
2.4.9
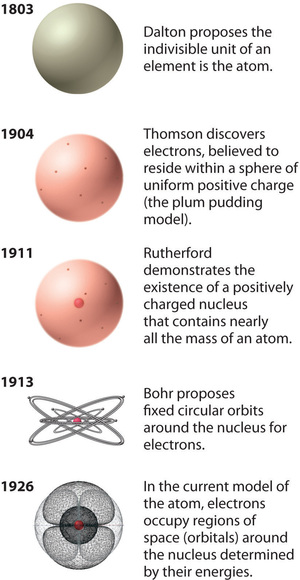
Rysunek \(\): Ewolucja teorii atomowej, zilustrowana modelami atomu tlenu. Model Bohra i obecny model są opisane w rozdziale 6, „Struktura atomów”. Obraz użyty za pozwoleniem (CC BY-SA-NC).
Model atomu Rutherforda jest zasadniczo taki sam jak model współczesny, z wyjątkiem tego, że teraz wiadomo, że elektrony nie są równomiernie rozmieszczone w całej objętości atomu. Zamiast tego, s± one rozmieszczone zgodnie z zasadami opisanymi przez mechanikę kwantow±. Rysunek pokazuje, jak model atomu ewoluował w czasie od niepodzielnej jednostki Daltona do nauczanego obecnie nowoczesnego poglądu.