Autoregulacja mózgowego przepływu krwi
Autoregulacja mózgowego przepływu krwi jest zdolnością mózgu do utrzymania względnie stałego przepływu krwi pomimo zmian ciśnienia perfuzyjnego . Autoregulacja jest obecna w wielu naczyniowych łóżkach, ale jest szczególnie dobrze rozwinięta w mózgu, prawdopodobnie z powodu potrzeby stałej dostawy krwi i homeostazy wody. W normotensyjnych dorosłych, mózgowy przepływ krwi jest utrzymywany na poziomie ~50 mL na 100 g tkanki mózgowej na minutę, pod warunkiem, że CPP jest w zakresie ~60 do 160 mmHg . Powyżej i poniżej tej granicy, autoregulacja jest utracona i mózgowy przepływ krwi staje się zależny od średniego ciśnienia tętniczego w sposób liniowy. Kiedy CPP spada poniżej dolnej granicy autoregulacji, dochodzi do niedokrwienia mózgu. Zmniejszenie mózgowego przepływu krwi jest kompensowane przez wzrost ekstrakcji tlenu z krwi. Kliniczne oznaki lub objawy niedokrwienia pojawiają się dopiero wtedy, gdy spadek perfuzji przekracza zdolność zwiększonej ekstrakcji tlenu do zaspokojenia potrzeb metabolicznych. W tym momencie pojawiają się kliniczne objawy hipoperfuzji, w tym zawroty głowy, zmieniony stan psychiczny, a ostatecznie nieodwracalne uszkodzenie tkanki (zawał) .
Mechanizmy autoregulacji w mózgu nie są całkowicie zrozumiałe i prawdopodobnie różnią się przy wzrostach vs. spadkach ciśnienia. Chociaż rola neuronalnego zaangażowania w autoregulację jest pociągająca, badania wykazały, że autoregulacja mózgowego przepływu krwi jest zachowana u współczulnie i przywspółczulnie zdenerwowanych zwierząt, wskazując, że główny udział zewnątrzpochodnych czynników neurogennych w autoregulacji mózgowego przepływu krwi jest mało prawdopodobny (patrz unerwienie okołonaczyniowe). Ostatnio wykazano rolę neuronalnego tlenku azotu w modulowaniu autoregulacji mózgowego przepływu krwi, co sugeruje, że chociaż unerwienie zewnątrzpochodne może nie być zaangażowane, wewnętrzne unerwienie może odgrywać pewną rolę. Biprodukty metabolizmu zostały również zaproponowane, aby mieć rolę w autoregulacji . Zmniejszenie mózgowego przepływu krwi stymuluje uwalnianie substancji wazoaktywnych z mózgu, które powodują rozszerzenie tętnic. Kandydatami na te wazoaktywne substancje są H+, K+, O2, adenozyna i inne. Autoregulacja mózgowego przepływu krwi, gdy ciśnienie waha się na wysokim końcu krzywej autoregulacji, jest najprawdopodobniej spowodowana miogennym zachowaniem mięśni gładkich mózgu, które zwężają się w odpowiedzi na podwyższone ciśnienie i rozszerzają w odpowiedzi na obniżenie ciśnienia. Istotny udział aktywności miogennej w autoregulacji jest wykazany in vitro w izolowanych i poddanych ciśnieniu tętnicach mózgowych, które zwężają się w odpowiedzi na podwyższone ciśnienie i rozszerzają w odpowiedzi na obniżenie ciśnienia (patrz Myogenic Response). Autoregulacja przy ciśnieniach poniżej zakresu ciśnienia miogennego prawdopodobnie obejmuje niedotlenienie i uwolnienie czynników metabolicznych .
Znaczenie autoregulacji w normalnej funkcji mózgu jest podkreślone przez fakt, że znaczne uszkodzenie mózgu występuje, gdy mechanizmy autoregulacyjne są utracone. Na przykład, podczas ostrego nadciśnienia przy ciśnieniach powyżej autoregulacyjnej granicy, miogenne zwężenie naczyniowego mięśnia gładkiego jest pokonane przez nadmierne ciśnienie wewnątrznaczyniowe i przymusowe rozszerzenie naczyń mózgowych występuje . Utrata napięcia miogennego podczas wymuszonego rozszerzenia zmniejsza opór naczyniowo-mózgowy, co może powodować duży wzrost mózgowego przepływu krwi (300-400%), znany jako przełom autoregulacyjny (ryc. 16). Ponadto zmniejszony opór naczyniowo-mózgowy zwiększa ciśnienie hydrostatyczne na śródbłonku mózgu, powodując powstawanie obrzęku, co jest przyczyną takich stanów, jak encefalopatia nadciśnieniowa, zespół tylnej odwracalnej encefalopatii (PRES) i rzucawka (patrz Tworzenie obrzęku naczyniopochodnego).
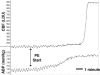
RYSUNEK 16
Śledzenie CBF (w jednostkach Dopplera laserowego) i ABP (w mmHg) w odpowiedzi na wzrastające dawki PE. W tym eksperymencie CBF wzrósł czterokrotnie w porównaniu z wartością wyjściową, gdy ABP wzrosło z 140 do 210 mmHg, demonstrując przełom autoregulacyjny. Stosowane (więcej…)
Although uncommon uncommon since the advent of effective antihypertensive therapy, hypertensive encephalopathy occurs as a result of a sudden, sustained rise in blood pressure sufficient to exceed the upper limit of cerebral blood flow autoregulation (>160 mmHg) . Wczesne badania nad reakcją naczyń mózgowych na wysokie ciśnienie krwi doprowadziły do powstania koncepcji nadciśnieniowego skurczu naczyń. Uważano, że ostra encefalopatia nadciśnieniowa jest wynikiem skurczu-;definiowanego jako niekontrolowany skurcz naczyń-;tętnic mózgowych, powodujący niedokrwienie tkanki mózgowej. Koncepcja ta wywodzi się z obserwacji Byroma, który wytworzył eksperymentalne nadciśnienie nerkowe i stwierdził, że ~90% szczurów z nadciśnieniem z objawami neurologicznymi wykazało liczne korowe plamy wynaczynienia błękitu trypanu, podczas gdy szczury bez objawów mózgowych wydawały się mieć normalną przepuszczalność naczyń mózgowych. Zauważył również to, co nazwał naprzemiennym zwężeniem/rozszerzeniem naczyń w naczyniach tętniczych, zjawisko znane jako wygląd „sznurka kiełbasianego”. Ta obserwacja doprowadziła go do wniosku, że skurcz naczyń mózgowych spowodował niedokrwienie i powstanie obrzęku w odpowiedzi na ostre nadciśnienie. Później Byrom zmodyfikował swój pogląd i powołał się na odkrycie w krążeniu krezkowym, że naczynia o wyglądzie „kiełbasianej struny” miały wyciek białka tylko w rozszerzonych częściach naczyń. Od tego czasu ustalono, że wysokie ciśnienie krwi powoduje zwiększony mózgowy przepływ krwi i „przełamanie autoregulacji”. Dalsze eksperymenty potwierdziły, że utrata miogennej wazokonstrykcji podczas wymuszonego rozszerzenia, a nie skurcz, jest krytycznym wydarzeniem w encefalopatii nadciśnieniowej .
.